지난해 생물학적 동등성시험은 전년보다 큰 폭 늘었다. 재심사 또는 특허만료 예정인 제네릭 의약품 개발을 위한 허가 승인이 가장 많았고 정신신경계와 심혈관계 의약품이 증가를 주도했다.
식품의약품안전처(처장 김승희)는 지난해 제네릭의약품 허가를 위한 생물학적 동등성시험 계획 승인이 201건으로 전년도에 비해 약 30% 증가했다고 23일 밝혔다.
생물학적 동등성시험(생동성시험)은 동일 주성분을 함유한 두 제제의 생체이용률이 통계학적으로 동등하다는 사실을 보여주게 된다.
승인건수는 1개 품목을 여러 제약사가 공동으로 진행하는 생동성시험이 가능해진 2011년 이후 감소 추세를 보였다. 실제 제네릭의약품 허가 목적 승인은 지난 2013년 163건에서 2014년 156건으로 줄었다.
하지만 2015년에는 전년에 비해 재심사 또는 특허 만료 예정 의약품이 109건에서 148건으로 늘어나면서 승인 건수가 증가했다.
지난해 승인된 생동성시험의 주요 특징은 ▲치료영역별 정신신경계의약품 개발 최다 ▲재심사 또는 특허 만료예정인 의약품 개발 집중 등이다.
정신신경계‧심혈관계 의약품 ‘최다’
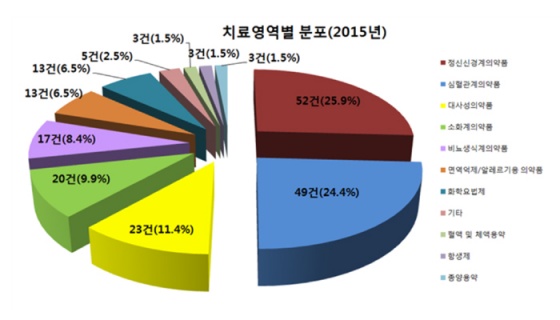
치료영역별 승인건수는 정신신경계의약품 52건(25.9%)와 심혈관계의약품 49건(24.4%)이 절반 이상을 차지했다.
이어 대사성의약품 23건(11.4%), 소화계의약품 20건(9.9%), 비뇨‧생식기계의약품 17건(8.4%), 화학요법제 13건(6.5%) 등의 순이었다.
실제 스트레스 증가와 고령화 등의 영향으로 불안 우울장애, 치매 등을 치료하는 정신신경계의약품이 2011년 이후 4년 연속으로 가장 많이 승인됐다. 심혈관계의약품의 개발도 매년 꾸준히 이뤄지고 있다.
화학요법제는 2014년에 승인건수가 2건에서 지난해 13건으로 급격히 증가했다. 이는 특허만료에 따라 화학요법제에 대한 개발이 많았기 때문인 것으로 분석됐다.
반면 비뇨‧생식기계의약품의 경우 타다라필 등의 특허만료로 2014년에는 33건으로 증가했으나, 2015년에는 개발이 주춤, 17건으로 급감했다.
재심사·특허 만료예정 의약품 타깃
지난해 재심사 또는 특허만료 예정인 제네릭의약품 개발을 위한 생동성시험 승인건수는 148건으로 전체(201건)의 73.6%에 달했다.
올해 6월 재심사가 만료되는 텔미사르탄, 암로디핀 복합제가 11건으로 가장 많았다. 뇌기질성 정신증후군에 사용되는 콜린알포세레이트와 치매치료제 도네페질이 각각 뒤를 이었다.
지난해 승인을 처음받은 성분인 테노포비르와 티카글렐러는 오는 2017년 재심사 만료예정인 품목이다.
재심사는 신약의 허가 후 안전성·유효성 및 적정한 사용을 위해 필요한 정보를 수집해 심사하는 제도다. 재심사기간 동안 제네릭의약품 허가는 제한한다.
식약처 관계자는 “스트레스 증가 및 고령화 등의 영향으로 심혈관계의약품, 정신신경계의약품의 개발이 증가 추세에 있다”면서 “재심사 또는 특허만료예정 의약품에 대한 개발도 지속적으로 증가할 것”이라고 전망했다.