 국내제약사가 심혈을 기울여 자체 개발한 토종신약이 현재까지 35개가 허가된 것으로 확인됐다.
국내제약사가 심혈을 기울여 자체 개발한 토종신약이 현재까지 35개가 허가된 것으로 확인됐다.
하지만 이 중 약 3분의 1은 허가를 취하하거나 실적이 없어 사실상 시장에서 퇴출된 것으로 나타났다.
특히 올해는 업체가 자진해서 허가를 취하한 품목이 3개나 됐다.
식약처에 따르면 국산 신약으로 허가받은 의약품은 총 35개였다.
최초 허가받은 국산신약은 SK케미칼 ‘선플라주’다. 가장 최근에는 대웅제약 펙스클루, SK바이오사이언스 ‘스카이코비원’ 등이 승인됐다.
대원제약 ‘펠루비’, 일양약품 ‘놀텍’, 보령제약 ‘카나브’, LG화학 ‘제미글로’, 종근당 ‘듀비에’, 동아에스티 ‘슈가논’, HK이노엔 ‘케이캡’ 등이 연간 100억원이 훌쩍 넘는 블록버스터 품목으로 성장했다.
반면 일부 품목은 제대로 팔아보지도 못한 채 시장에서 사장됐으며, 또 일부는 허가 취하를 하기에 이르렀다.
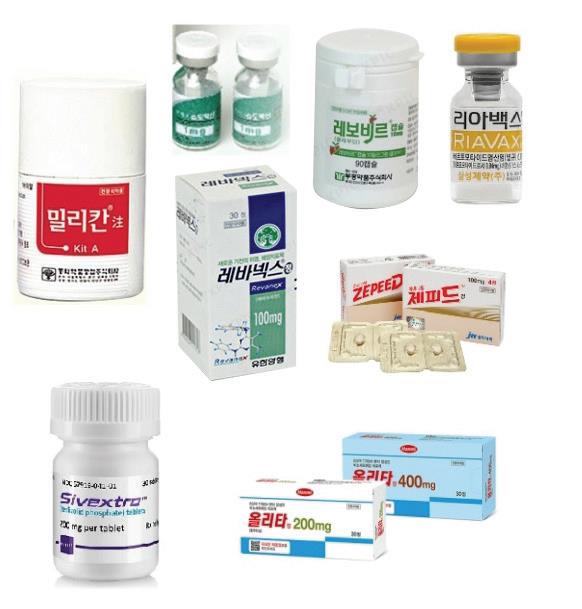
국신 신약 중 허가 취하를 한 품목은 9개 품목이다. ▲동화약품 ‘밀리칸주’ ▲CJ헬스케어 ‘슈도박신주’ ▲유한양행 ‘레바넥스100mg’ ▲부광약품 ‘레보비르10mg’ ▲JW중외 ‘제피드’ ▲삼성제약 ‘리아벡스주’ ▲동아에스티 ‘시벡스트로정’ ▲동아에스티 ‘시벡스트로주’ ▲한미약품 '올리타정' 등이다.
다만 유한양행과 부광약품은 각각 레바넥스주 200mg, 레보비르30mg은 허가를 유지하고 있다.
이 중 올해 들어 업체가 허가를 자진 취하한 품목은 레바넥스100mg, 제피드, 올리타주 등이 해당된다.
코로롱생명과학 ‘인보사주’는 29호 국산신약이었으나, 허가 과정에서 서류 허위 조작 등의 이유로 신약에서 제외되는 수모를 겪었다.
또 국산신약으로서 허가는 유지하고 있으나 생산을 하지 않거나 처방이 미미해 명맥만 유지하는 품목도 있다.
선플라주와 아피톡신은 생산을 중단했으며, 이지에프외용액, 캄토벨, 자보란테 등은 실적은 있지만 연간 처방액이 미미한 수준이다.
국산 신약 중 허가 취하품목과 생산 중단, 실적이 미미한 제품까지 합하면 약 14개 품목이 시장성이 없는 셈이다. 이는 국산 신약 34개 중 약 3분의 1에 해당되는 수치다.
국산 신약 중 시벡스트로는 낮은 약가 때문에 출시를 포기했으며 슈도박신주, 밀리칸주, 올리타정 등은 조건부 허가를 받아 놓고 임상 3상을 마치지 못하고 허가를 취하하는 등의 악재를 겪기도 했다.
제약업계 관계자는 “국내제약사들의 신약 개발 능력이 과거보다 향상되고 선진국과 격차도 줄어들고 있으나, 아직까지 글로벌 신약이라고 할 만한 신약은 없다”고 말했다.
이어 “토종 신약이 개발됐다고 해도 환영받는 시대는 이미 지났다”며 “글로벌에서 통할 만한 신약을 개발하는 것이 중요하다”고 덧붙였다.
[위 내용은 데일리메디 오프라인 가을호에서도 볼 수 있습니다]
