
국내 제약사 주도 의약품 임상시험이 전년 대비 한 계단 상승한 세계 점유율 5위를 차지했다.
식품의약품안전처(처장 오유경)와 국가임상시험지원재단(이사장 박인석)은 이 같은 내용을 담은 ‘2022년 의약품 임상시험 승인 현황’을 발표했다.
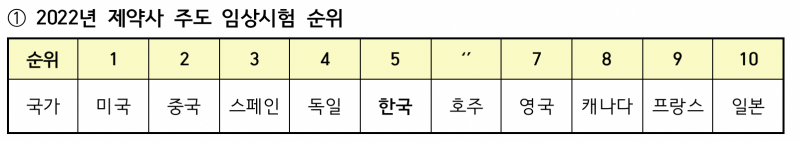
지난해 전 세계 임상시험 등록 건수에서 우리나라가 ‘국가별 점유율’ 5위를 기록, 역대 최고 순위를 갱신했다. 2019년 8위, 2020년과 2021년 모두 6위에서 한 단계 도약한 것이다.
전 세계 ‘도시별 임상시험’에서 서울은 4년 연속 1위, ‘단일국가 임상시험’은 우리나라가 3위로 예년과 동일한 순위를 유지했다.
‘다국가 임상시험’은 유럽 국가의 점유율이 높아지며 우리나라는 전년 대비 한 계단 하락한 11위였다. 그러나 아시아 국가 중에서는 여전히 가장 높은 순위를 기록했다.
제약사 주도 전 세계 임상시험 등록 수는 2019년 8196건에서 2020년 9713건, 2021년 1만1008건에서 2022년 7983건으로 큰 폭으로 줄었다.
식약처는 "글로벌 경기침체에 따른 신약 개발 R&D 투자의 위축과 코로나19 관련 의약품의 임상시험 감소 등의 영향으로 제약사 주도 전 세계 임상시험 등록 건수가 전년 대비 27.7%하락했다"고 분석했다.
지난해 국내 임상시험의 특징은 임상시험 승인 건수가 코로나19 유행 이전 수준으로 회귀했고, 제약사 주도 임상시험 비중이 늘었다.
먼저 작년 국내 임상시험 승인 건수는 전 세계 임상시험 감소 추이에 따라 전년 대비 15.6% 감소한 711건으로 코로나19 유행 이전(2019년)과 유사한 수준으로 돌아갔다.
우리나라 전체 임상시험 승인 건수는 2019년 714건에서 2020년 799건, 2021년 842건, 2022년 711건으로 집계됐다.

또한 전체 임상시험 중 ‘제약사 주도 임상시험’ 승인 건수는 595건으로, 전체 임상시험 승인 건수 중 83.7%를 차지하며 전년(80.6%) 대비 3.1%P 증가했다.
‘연구자 임상시험’은 승인 건수와 비중 모두 감소했다. 2020년 188건에서 2021년 163건, 2022년 116건으로 대폭 하락했다.
아울러 해외 제약사가 개발한 의약품을 사용한 임상시험은 전년 대비 15.1% 감소했으며, 국내 제약사가 개발한 의약품을 사용한 임상시험도 8.5% 하락했다.
식약처는 "국가임상시험지원재단과 함께 우리나라에서 진행되는 신약 개발 과정이 더욱 신속하고 안전하게 진행될 수 있도록 적극적으로 지원하겠다"고 밝혔다.
이어 "임상시험의약품에 대한 안전성 정보 관리 강화 등 임상시험 참여자 안전과 권익 보호를 위해 지속적으로 제도를 개선하고, 비대면 임상시험 및 신기술 의약품 개발 등 급속한 임상시험 환경 변화에 선제적으로 대응해 국내 임상시험이 국제 표준을 선도할 수 있도록 최선을 다하겠다"고 덧붙였다.
 양보혜 기자 (
양보혜 기자 (