

가슴 성형(유방확대수술)에 사용되는 실리콘겔 인공유방을 국내 의료시장에 공급하는 기업 가운데 최근 5년간 부작용 보고가 가장 많은 곳은 한국애브비로 조사됐다.
실리콘겔 인공유방은 가슴 성형에 쓰이는 대표적인 인체 삽입 의료기기인 만큼 철저한 추적 관리가 필요하다는 지적이다.
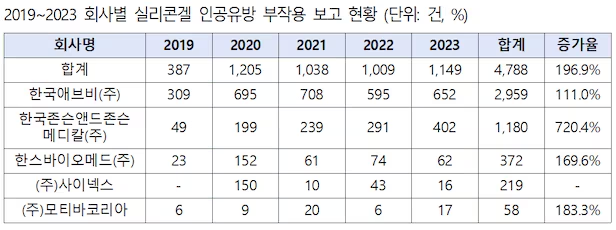
12일 국회 보건복지위원회 소속 서영석 더불어민주당 의원이 식품의약품안전처로부터 제출받은 자료에 따르면 최근 5년간(2019~2023년) 실리콘겔 인공유방 부작용 누적 보고 건수 4788건을 기록했다.
이중 한국애브비 부작용 보고는 총 2959건으로 전체 61.8%를 차지했다. 이어 한국존슨앤드존슨메디칼 1180건, 한스바이오메드 372건, 사이넥스 219건, 모티바코리아 58건 등으로 보고됐다.
2019년 대비 부작용 보고 증가율이 가장 높은 제조사는 720.4% 증가한 한국존슨앤드존슨메디칼이다.
실리콘겔 인공유방은 대표적인 인체 삽입 의료기기로 부작용이 발생할 경우 치명적인 피해가 발생할 확률도 높다.
실제 2019년 아일랜드 기업 엘러간이 생산한 거친 표면 인공유방 보형물 '엘러간'은 희귀암 유발 가능성이 제기되면서 전 세계적인 이슈를 낳았다.
이른바 '엘러간 사태'로 불리는 이 사건은 미국 식품의약국(FDA)이 엘러간이 다른 제조사 제품보다 림프종을 유발할 가능성이 약 6배 높다며 리콜 조치를 하면서 촉발됐다.
당시 전 세계적으로 손해배상 소송이 이어진 것은 물론 국내에서도 3건의 희귀암 발병 사례가 보고되면서 충격에 빠졌다.
식약처는 엘러간과 협의해 거친 표면 유방 보형물 이식환자에 대한 보상대책을 마련했고 앨러간 거친 표면 인공유방 보형물을 이식한 후 희귀암이 발병한 환자는 진단 및 치료 등 의료실비 전액을 보상키로 했다.
이 외에도 국내 기업인 한스바이오메드는 허가받지 않은 원료로 인공유방 보형물을 제조해 논란을 빚은 바 있다.
한스바이오메드는 '벨라젤' 제조에 사용된 원료가 인체에 무해하다는 시험 결과를 발표하면서 사태를 수습했지만 현재 제품은 시장에서 퇴출된 상태다.
 구교윤 기자 (
구교윤 기자 (