뉴스 - 행정/법률

혁신 신약 최초 '유방암치료제 트로델비' 통과
약제급여평가委, 폐동맥고혈압 치료제 아뎀파스도 급여 적정성 '인정'
조재민 기자 (jojo@dailymedi.com)
2025.02.06 21:34
 길리어드의 삼중음성 유방암 치료제 '트로델비(성분명 사시투주맙고비테칸)'가 약제급여평가위원회를 통과해 급여 적정성을 인정받았다.
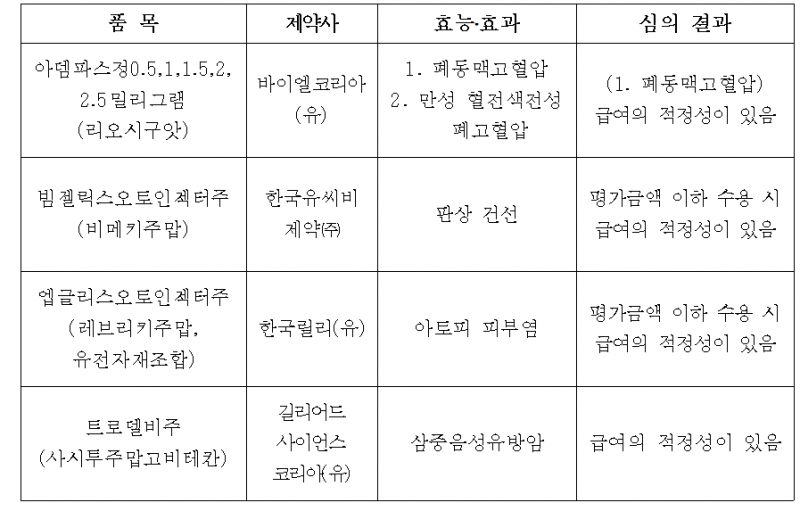
길리어드의 삼중음성 유방암 치료제 '트로델비(성분명 사시투주맙고비테칸)'가 약제급여평가위원회를 통과해 급여 적정성을 인정받았다.
이번 악평위 통과는 ‘혁신 신약 제도’로 추진된 제도 개선 첫 사례로 기록됐다.
건강보험심사평가원은 6일 2025년 제2차 약제급여평가위원회 심의 결과를 공개했다.
이번 약평위에서는 트로델비 승인여부에 관심이 쏠렸다. 트로델비는 정부의 혁신 신약 우대조건을 모두 만족해 혁신 식약제도의 이정표가 될 수 있기 때문이다.
트로델비는 1사이클(3주) 약값이 약 1500~2000만원으로 연간 약값만 수억원에 달해 지속적인 급여화 요구가 이어졌다.
트로델비는 혁신신약인 ▲대체 가능 또는 치료적 위치가 동등한 제품 또는 치료법이 없는 경우 ▲생존기간 연장 등 임상적 의미 있는 개선이 입증된 경우 ▲식약처 신속심사 허가된 신약(GIFT) 또는 미국 식품의약국(FDA)의 획기적 의약품 지정(BTD), 유럽 EMA 신속심사(PRIME)로 허가된 경우 등 모든 조건을 충족했다.
길리어드 트로델비 외에도 바이엘코리아의 폐동맥고혈압 치료제 ‘아뎀파스정’(리오시구앗)도 급여 적정성을 인정받았다.
반면 한국유비씨제약의 판상 건선 치료제 ‘빔젤릭스’(비메키주맙)와 한국릴리 아토피피부염 치료제 ‘엡글리스’(레브리키주맙)는 평가금액 이하 수용 시 급여 적정성을 인정받았다.
저작권자 © 데일리메디 무단전재및 재배포 금지
 조재민 기자 (
조재민 기자 (