
암세포는 면역계의 T세포 공격을 피하는 '은폐 기제(cloaking mechanism)'를 갖고 있다.
이런 은폐술을 부리는 암세포의 단백질 가운데 하나가 '1형 세포 예정사 리간드(programmed death ligand 1)'라는 뜻을 가진 PD-L1이다.
면역 관문 억제제는, PD-L1과 T세포 표면에 존재하는 PD-L1 수용체 사이의 상호작용을 차단해, 암세포가 숨지 못하게 방해한다.
현재 상용화돼 있는 니보루맙(nivolumab)이나 펨브롤리주맙(pembrolizumab) 같은 암 면역 치료제는 모두 이런 기제로 작용하는 것이다.
이런 유형의 면역 치료제는 특히 치명률이 높은 비소세포폐암(NSCLC) 등의 치료에 고무적인 효과를 보였다.
면역계 공격 피하는 은폐 기제의 '핵심 단백질' 발견
하지만 PD-L1의 발현도가 높을 때 암세포가 어떻게 인체의 면역 공격을 피하는지는 지금까지 잘 알지 못했다.
이 오랜 미스터리를 풀 수 있는 중요한 실마리를 미국 텍사스대 사우스웨스턴 메디컬 센터(UTSW) 연구진이 찾아냈다. 관련 논문은 24일 '네이처 캔서(Nature Cancer)' 온라인판에 실렸다.
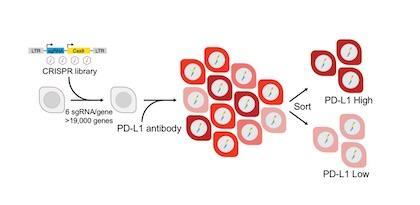
[UTSW 제공]
연구팀은 크리스퍼 유전자 편집 가위로 인간 비소세포폐암 세포주의 유전자 1만9천개를 각각 따로 제거하면서, 형광 PD-L1 항체로 PD-L1의 세포 발현도 차이를 관찰했다. PD-L1 생성을 촉진하는 유전자와 억제하는 유전자를 가려내기 위해서였다.
놀랍게도 PD-L1 생산을 잠정적으로 억제하는 건, 헴(heme)의 생성에 중요한 작용을 하는 UROD 유전자였다.
헴은 적혈구의 산소 운반에 꼭 필요하고, 일반 세포의 항상성 유지에도 폭넓게 관여한다.
UROD 유전자를 제거한 암 종양을 건강한 생쥐에 이식했더니, 면역 시스템이 작동하지 않는 생쥐보다 종양이 훨씬 더 빨리 자랐다.
이는 PD-L1 생성 유전자를 자극하면 암에 맞서는 면역성이 약해지고, 종양의 성장은 촉진된다는 걸 의미한다.
또한 헴의 생성을 방해하면 '통합 스트레스 반응(IRS)' 경로가 활성화한다는 것도 밝혀졌다. 이 경로는 저산소, 독물, 영양 결핍 등 세포 스트레스 대응에 폭넓게 이용된다.
비소세포폐암은 이런 스트레스 조건에서 특정 단백질(eIF5B)에 의존하는 특수한 기제를 이용해 PD-L1의 생성을 늘렸다.
연구팀은 eIF5B 생성 코드를 가진 유전자가 폐암에서 자주 과도하게 발현한다는 걸 확인했다. 실제로 이 단백질이 과도히 발현한 폐암 환자는 예후가 좋지 않았다.
UTSW의 캐스린 A. 오도넬 분자생물학 부교수는 "eIF5B 단백질이나 PD-L1 생성에 관여하는 단백질을 표적으로 새 약제를 개발하면 면역치료 성공률을 높일 수 있을 것"이라고 말했다.
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
 연합뉴스 기자 (
연합뉴스 기자 (