 [데일리메디 양보혜 기자] 말기 위암 환자들이 손꼽아 기다리던 세계 최초 경구용 항암제 ‘리포락셀액’이 ‘약가협상’이란 장벽에 부딪혀 시장 진입에 어려움을 겪고 있다.
[데일리메디 양보혜 기자] 말기 위암 환자들이 손꼽아 기다리던 세계 최초 경구용 항암제 ‘리포락셀액’이 ‘약가협상’이란 장벽에 부딪혀 시장 진입에 어려움을 겪고 있다.
건강보험심사평가원과 대화제약이 1년 반에 걸친 릴레이 협상을 진행했지만 답보 상태에 빠진 까닭은 무엇일까.
12일 업계에 따르면 지난 6월 28일 열린 제9차 약제급여평가위원회 평가에서 파클리탁솔 주사제를 경구용 제품으로 개발한 대화제약 '리포락셀'이 조건부 비급여 판정을 받았다.
리포락셀은 위암 적응증으로 2016년 9월 식약처로부터 허가를 획득했다. 항암제를 집에서 복용할 수 있고, 부작용도 적으며, 세계 최초로 개발돼 시장성이 좋아 환자, 의료진, 제약업계의 '기대주'로 부상했다.
개량신약이지만 국내 임상 1상, 2상, 3상을 모두 마쳤으며, 정부로부터 기술력 및 제품 가치를 인정 받아 연구개발비 75억원(전체 연구비의 35%)을 지원 받기도 했다.
'순풍에 돛단듯' 전진하던 리포락셀은 시판을 앞둔 상황에서 약가협상이란 예상치 못한 암초에 걸렸다. 심평원이 대화제약의 예상보다 훨씬 낮은 제네릭 수준의 약가를 제안했기 때문이다.
리포락셀은 동일성분 주사제(탁솔)가 있어 개량신약(자료제출의약품)으로 허가 받았으며, 자료제출의약품 중 가장 개발 난이도가 높은 '새로운 투여경로 의약품'으로 분류됐다.
이 경우 다른 개량신약과 달리 산정기준 적용을 받지 못하고, 신약과 동일한 약가 등재 절차를 거쳐야 하는 '협상대상약제'로 구분된다.
두 기준의 가장 큰 차이점은 비교 대상 약제와 가격 계산법이다. 전자의 경우 오리지널 약가 대비 100~110%로 약가가 결정되지만, 후자의 경우 '오리지널+제네릭'의 가중평균가격을 기반으로 최저기준 약가를 산출한다.
이 방식에 따라 대화제약은 오리지널 탁솔주 30mg가격이 아닌 5개 함량(30, 100, 150, 200, 300mg) 제네릭 포함 모든 파클리탁셀주사제의 판매량을 가중한 가격을 기준으로 계산해 약가를 신청했다.
그러나 심평원의 전혀 셈법은 달랐다. 주사제의 경우 조합이 가능하다면 가장 경제적(저렴한)인 가격을 기준으로 삼는다는 원칙을 내세워, 처방액의 90%를 차지하는 30, 100mg은 비교 대상에서 제외하고, 저조한 300mg의 가중평균가격을 제시했다.
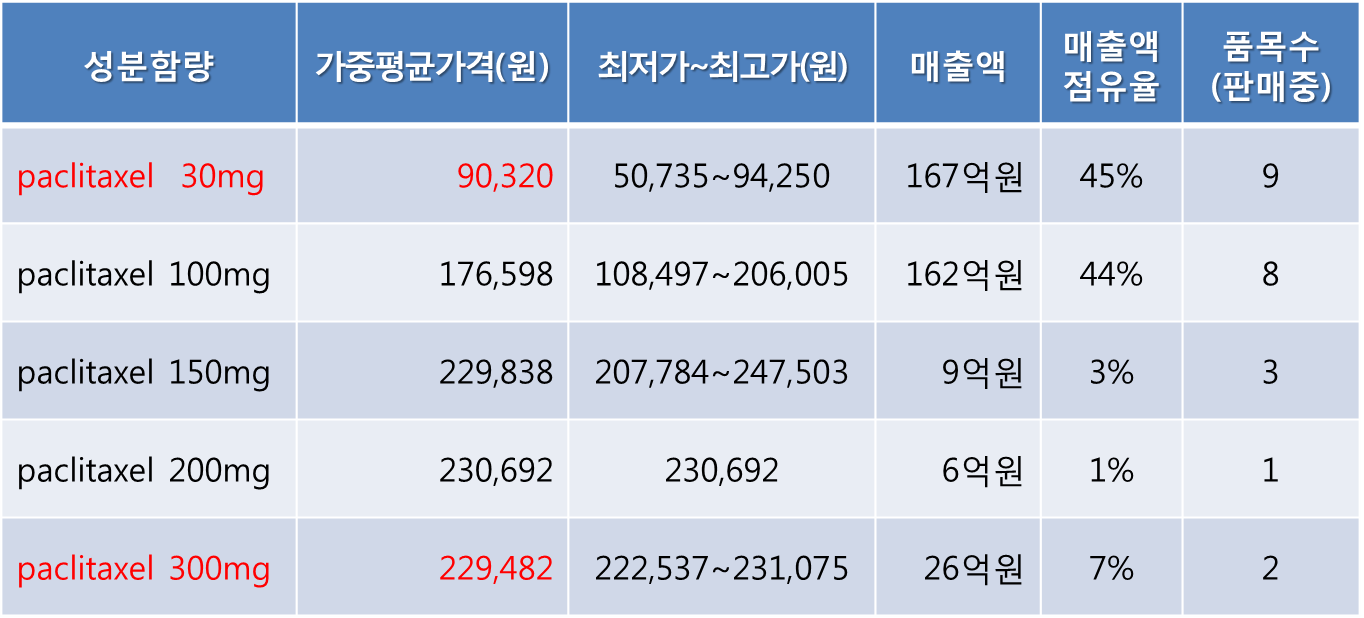 눈여겨봐야 할 점은 파클리탁솔 주사제 300mg이 150, 200mg의 가중평균가격보다 싸다는 것이다. 30mg보다 10배 용량임에도 가격이 2.5배 이내로 낮게 형성돼 있다.
눈여겨봐야 할 점은 파클리탁솔 주사제 300mg이 150, 200mg의 가중평균가격보다 싸다는 것이다. 30mg보다 10배 용량임에도 가격이 2.5배 이내로 낮게 형성돼 있다.  양보혜 기자
양보혜 기자