[데일리메디 양보혜기자] 앞으로 국내에 코로나19 백신 등을 비롯한 생물학적제제가 신속하게 공급될 전망이다.
식품의약품안전처(처장 김강립)는 이 같은 내용을 담은 '생물학적제제 등의 품목허가·심사 규정'을 5일자로 개정·시행한다고 밝혔다.
생물학적제제는 보건위생상 특별한 주의가 필요한 의약품으로 분류돼 있다.
여기에는 백신, 혈액·혈장분획제제, 독소·항독소, 유전자재조합의약품 등이 포함된다.
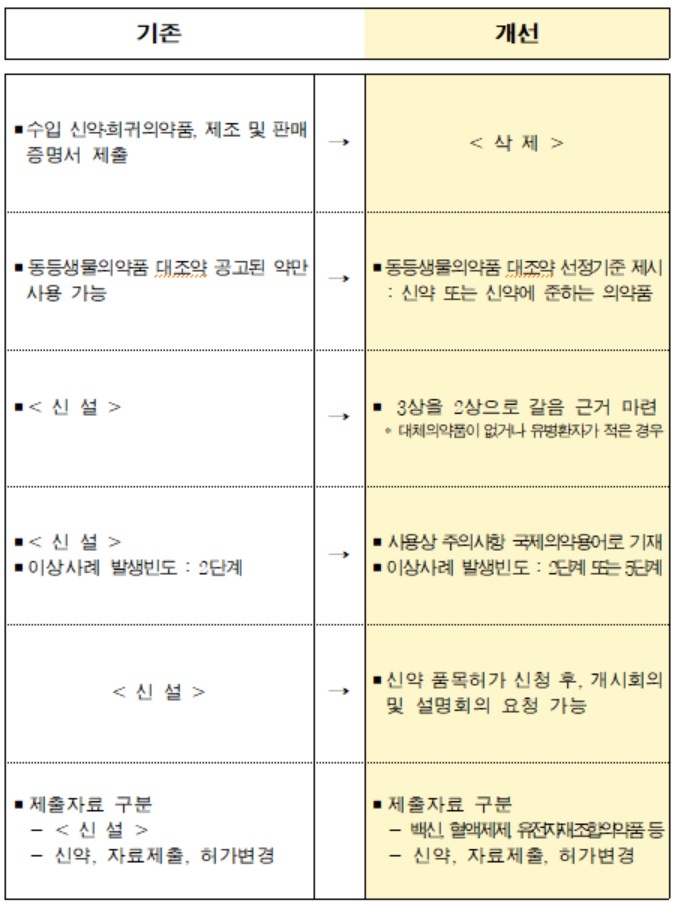
이번 개정안의 주요 내용은 ▲수입 신약 및 희귀의약품 제출자료 간소화 ▲동등생물의약품 대조약 선정방식 개선 ▲임상시험 자료 합리화 ▲국제의약용어 우선 사용 통한 국제조화 등이다.
수입 신약 및 희귀의약품 허가 신청 서류 중 기존에 제출해야 했던 수출국 정부당국 발행 ‘제조 및 판매증명서’ 제출을 면제한다.
이를 통해 감염병 대유행 예방·치료 의약품에 대해 식약처가 해외 규제당국 허가 여부와 별도로 평가하게 됨에 따라 신속한 허가 및 공급을 지원할 수 있다.
동등생물의약품 대조약으로 공고된 의약품만 사용가능하던 것을 신약 및 신약에 준하는 의약품으로 제약사가 선정·사용할 수 있도록 새 기준도 제시한다.
이번 조치로 동등생물의약품 개발을 촉진하고 보다 과학적 평가로 국민 안전 확보에 도움을 줄 것으로 예상된다.
또한 대체의약품이 없거나 임상시험 대상 환자 수가 극히 적은 경우 3상 임상시험을 2상 임상시험 자료로 갈음해 평가할 수 있는 법적근거를 마련한다.
이 경우 희귀·난치질환 치료제 허가의 어려움을 해소해 환자의 치료기회가 확보될 수 있다.
‘사용상 주의사항’에는 국제의약용어를 우선해 사용하도록 하고, 이상사례도 국제조화된 기준에 맞춰 용어와 발생빈도를 세분화한다.
그 밖에 신약 품목허가 신청 후 민원인이 허가·심사 담당부서에 설명회의 등을 요청할 수 있도록 ‘회의 신청제도’를 신설한다.
백신·혈액제제·유전자재조합의약품 등 제제별 특성을 반영해 품목허가 제출자료를 구체화하는 등의 내용도 포함된다.
식약처 관계자는 "앞으로도 과학적 심사에 기반한 생물학적제제 등의 품목 허가·심사를 통해 국민께 안전성·효과성·품질이 확보된 의약품을 공급할 수 있도록 지속적으로 제도를 정비하겠다"고 말했다.

양보혜 기자
 [데일리메디 양보혜기자] 앞으로 국내에 코로나19 백신 등을 비롯한 생물학적제제가 신속하게 공급될 전망이다.
[데일리메디 양보혜기자] 앞으로 국내에 코로나19 백신 등을 비롯한 생물학적제제가 신속하게 공급될 전망이다.  양보혜 기자
양보혜 기자