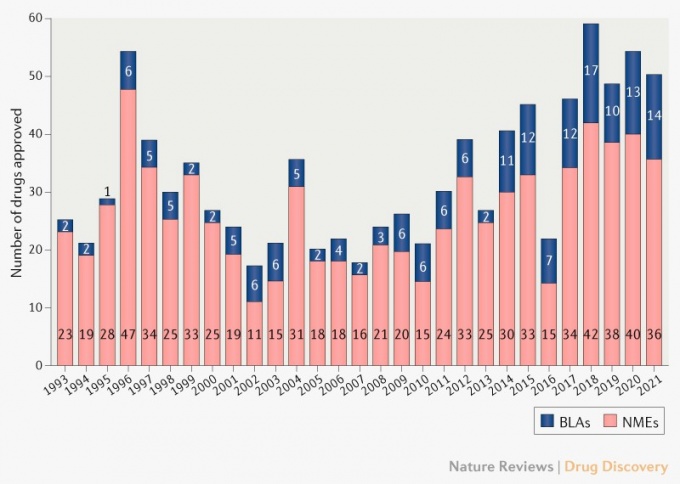
[데일리메디 신용수 기자] 2021년 미국 식품의약국(FDA)이 50건의 신규 의약품을 승인한 것으로 나타났다. 특히 생물학적 제제 허가의 경우 지난 2017년 이후 가장 많은 것으로 확인됐다.
네이처 등 외신에 따르면 FDA 의약품평가연구센터(CDER)는 지난해 총 50개 신규 의약품을 승인했다고 발표했다. 2020년 53개 대비 소폭 감소한 수치다. 5년 평균인 51개보다는 적지만, 10년 전인 24개보다는 2배 이상 늘어난 수치다.
특히 생물학적 제제 허가(BLA)의 경우 2021년 14건 허가가 이뤄지면서, 지난 2017년 17건 이후 가장 많은 건수의 허가가 완료됐다. 비율로도 전체 중 28%로 2017년(28.8%) 이후 가장 높았다. 합성의약품 허가(NME)는 올해 36건을 기록했다.
BLA를 종류별로 살펴보면 단클론항체(mAb)가 6건으로 가장 많았고, 항체-약물 접합체(ADC)와 효소가 각각 2개로 뒤를 이었다. 이중표적항체 1건과 기타 3건도 지난해 허가를 받았다.
NME의 경우 소분자 의약품이 34개로 가장 많았고, 이들 중에서 28개는 비펩타이트성 의약품이었다. 5종은 펩타이드 계열 의약품이었고, 방사성의약품도 1종 허가를 받았다.
NME 중 당지질체 의약품도 2건 있었다. 침묵RNA(siRNA) 치료제와 RNA 안티센스(Antisense)이 각각 1건씩 허가를 받았다.
이 같은 집계에 포함되지 않은 생물의약품 평가연구센터(CBER) 승인 의약품도 7건 있었다. 백신 및 유전자 요법 등 제품은 CBER 승인을 거친다.
올해는 BMS의 키메릭 항원 수용체 T세포(CAR-T) 치료제 2건과 화이자와 머크의 폐렴구균 예방 백신, 화이자의 진드기 매개 뇌염 백신, 엔지반트의 흉선 조직 치료제 레티믹, 화이자 코로나19 mRNA 백신 등이 CBER 승인을 받았다.
긴급사용승인(EUA)은 지난해 총 6건 진행됐다. 이들은 모두 코로나19 예방 및 치료 목적 의약품으로 얀센 코로나19 바이러스 벡터 백신과 릴리와 GMS, 아스트라제네카 단클론항체 치료제, 화이자와 머크 경구치료제 등이 있었다.
분야별로 보면 신규 승인 중 가장 큰 비중을 차지한 분야는 암이었다. 승인된 암 치료제는 15건으로 30%를 차지했다. 신경과 약물 또한 5개(10%)로 3년 연속 2위를 차지했다. 이외에도 감염성 질환과 심혈관계 질환이 각각 4건(8%)으로 뒤를 이었다.
‘블록버스터’급 적어, 코머니티‧프레브나르20‧아두헬름 등 물망
다만 올해 승인 제품들의 향후 시장 잠재력은 높지 않은 상황이다. 클래리베이트애널리틱스 등 의료 데이터 분석기관에 따르면, 지난해 추가 승인 포함 승인이 이뤄진 제품 중 연 매출 10억 달러(한화 1조2035억원) 이상을 기록할 것으로 예상되는 제품은 13개 제품에 그쳤다.
특히 연 매출 20억 달러를 돌파할 것으로 관측되는 제품은 화이자의 코로나19 백신과 폐렴 백신을 제외하면, 사실상 올해 뜨거운 감자로 떠올랐던 바이오젠의 ‘아두헬름’(성분명 아두카누맙)만이 유일했다.
클래리베이트는 화이자 코로나19 백신 ‘코머니티’ 예상 매출액을 350억 달러(42조1225억원)으로 책정했고, 화이자 폐렴 백신 ‘프레브나르20’은 44억달러(5조2954억원) 아두카누맙은 41억달러(4조9344억원)으로 예상했다.
아두헬름은 지난해 6월 FDA로부터 알츠하이머 치료제로 향후 임상4상 진행을 조건으로 조건부 허가를 획득했다. 하지만 이후 효능 및 부작용 논란에 휩싸이면서, 개발사인 바이오젠은 약가를 절반 이하로 낮추는 한편 올해 임상 4상을 진행하겠다는 계획을 밝혔다.

