
 지난해 임상시험 실시기관들은 품목허가 시 '기록·보고 미비'로 가장 많이 지적받았다. 이어 임상시험계획서 미준수, 임상시험용의약품 관리 부실 등이 주요 지적 및 권고사항으로 꼽혔다.
지난해 임상시험 실시기관들은 품목허가 시 '기록·보고 미비'로 가장 많이 지적받았다. 이어 임상시험계획서 미준수, 임상시험용의약품 관리 부실 등이 주요 지적 및 권고사항으로 꼽혔다.
식품의약품안전처는 이 같은 내용을 담은 '2022년 품목허가 관련 실태조사 결과'를 발표했다. 이번 조사에는 임상시험 실시기관 36개소와 CRO를 포함 의뢰기관 21개소가 참여했다.
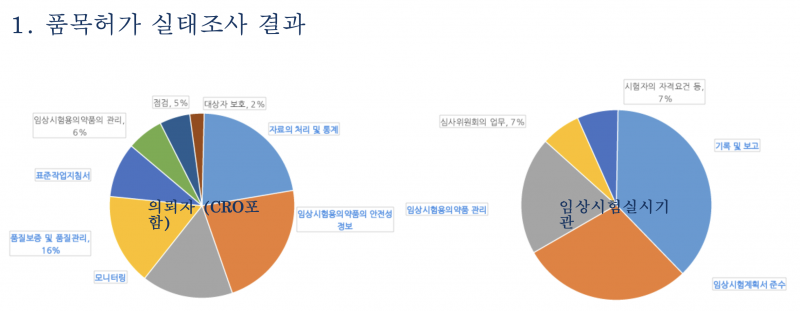
우선, 임상시험 실시기관 조사 결과부터 보면 가장 많은 지적사항으로 '기록 및 보고(38%) 미이행'이 꼽혔다.
예컨대 근거문서와 증례기록서 기록이 일치하지 않거나, 이상반응에 대한 인과관계 평가 사유 기록이 미비한 경우였다.
임상시험용 의약품 투여 시각, 이상반응 확인 시각 기록이 미비하거나 의약품 또는 검체 배송 관련 기록이 미확인되기도 했다.
또한 임상시험계획서 미준수(29%), 임상시험용의약품 관리 부실(20%) 등도 다빈도 지적사항으로 드러났다.
구체적으로 보면 임상시험계획서에서 명시된 내용과 달리 검체 채취 및 검사를 누락하거나, 검체처리 방법이나 유효성 평가 방법이 계획과 상이한 경우다.
무작위 배정번호를 확인하고 처방전을 작성해야 하지만 미리 처방전을 작성하고 무작위 배정을 실시한 후 그 사유를 누락하고 IRB에 미보고한 사례도 확인됐다.
임상시험용 의약품 인수 시 온도를 확인하지 않거나 시간 기록을 제대로 작성하지 않은 경우도 있었고, 냉장보관조건 의약품 보관 온도 등에 대한 기록이 미비하기도 했다.
임상시험 의뢰기관의 경우 '자료처리 및 통계 부적절'과 '안전성 정보 부적절'이 각각 22%로 가장 많은 지적사항으로 나타났다.
여기서 안전성 정보란 임상시험용의약품에 대한 관련한 정보 수집, 평가, 관리, 보고 절차 등을 포괄한다.
식약처 관계자는 "임상시험자료 처리 및 통계처리 절차가 적절하지 않거나 첫 대상자 등록 이후 증례기록서 개발이 완료한 사례가 있었다. 데이터 잠금 후 통계분석 계획이 변경되기도 했다"고 말했다.
이어 "중대한 이상반응에 대한 의뢰자의 의학적 평가 미실시 또는 근거자료 확인 불가, 임상시험 자료집 제·개정 검토 주기, 제·개정 절차 미흡 등도 주된 지적사항"이라고 부연했다.
식약처는 올해도 임상시험 실시기관을 대상으로 실사를 진행한다. 대상 품목은 국내 개발신약, 생물의약품, 조건부 품목허가 임상시험 등이며, 조사대상은 의뢰자 및 실시기관이다.
식약처 관계자는 "품목허가 신청 시 실태조사 대상 여부를 알려주고, 만약 대상이면 사전자료 제출 요청 및 실사 일정을 결정한다. 실사 후 결과를 공지하고 위반 시 행정처분을 내린다"고 설명했다.
이어 "실사 결과는 공개가 원칙이며, 공개 내용은 조사대상기관과 임상시험 제목, 조사결과 및 지적사항 등"이라며 "공개시점은 조사대상 기관에게 통보한 날로부터 180일 이내"라고 덧붙였다.
 ' ' . , .
' ' . , .
'2022 ' . 36 CRO 21 .
, ' (38%) ' .
, .
, .
(29%), (20%) .
, .
IRB .
, .
' ' ' ' 22% .
, , , .
" . " .
" , , " .
. , , , .
" , . " .
" , , " " 180 " .?

