

카이스트는 "생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과 협력해 이 같은 연구를 수행했다"고 8일 밝혔다.
칸디다증은 곰팡이균(진균) 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다.
최근 면역 저하 치료 및 장기이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다.
현재 사용 중인 칸디다 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가진 새로운 균의 출현으로 치료 효과가 떨어지고 있다.
특히 면역력이 저하된 환자들에게는 감염 진행이 빠르고 예후도 좋지 않아, 기존 치료제 한계를 극복할 수 있는 새로운 치료법 개발이 시급한 상황이었다.
이번에 연구팀이 개발한 치료제는 칸디다균만 선택적으로 치료하는데 성공했다.
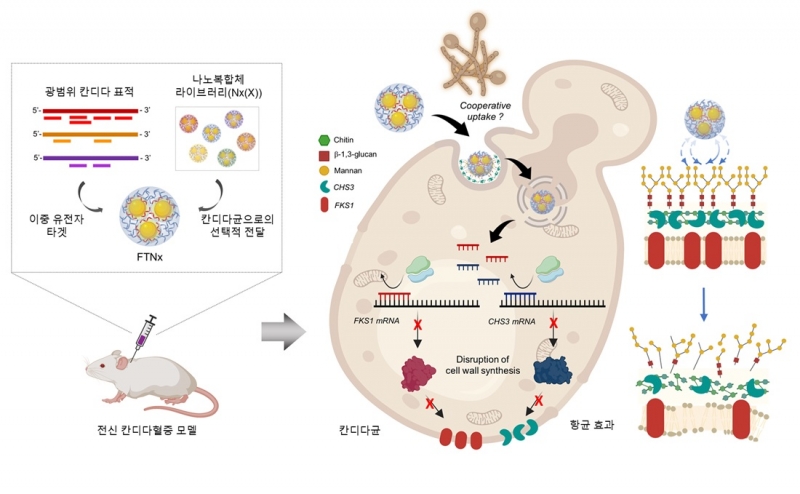 연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반 복합체를 제작했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용해 표적유도장치를 장착했다.
이에 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타깃팅 효과를 구현했다.
이 복합체는 칸디다 세포 내로 진입한 후 FKS1 및 CHS3 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴 합성을 동시에 차단한다.
이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며 세균 생존과 증식이 억제된다.
실제 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균(菌) 감소 및 면역반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라고 평가했다.
이어 “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행하겠다”고 덧붙였다.
이번 연구에는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7월 1일자에 게재됐다.

" " 8 .
() (Candida) .
, .
, .
, .
.
 1,3 (FKS1) (CHS3) DNA (antisense oligonucleotide, ASO) .
1,3 (FKS1) (CHS3) DNA (antisense oligonucleotide, ASO) .
( ) .
.
FKS1 CHS3 mRNA 1,3 .
.
, () , .
, .
.
1 , (Nature Communications) 7 1 .

