[데일리메디 양보혜 기자] 종근당이 지난해 가장 많은 임상시험을 진행한 것으로 나타났다. 수행기관으로는 서울대병원이 압도적이었다.
식품의약품안전처(처장 류영진)가 27일 공개한 2018년 임상시험계획 승인 결과에 따르면 종근당이 25건으로 가장 많았고 한미약품 14건, CJ헬스케어 11건 등이 뒤를 이었다.
다국적제약사의 경우 한국노바티스 22건, 한국엠에스디 20건, 한국아스트라제네카 19건 순이었다.
연구자 임상시험은 서울대병원이 24건으로 가장 많았고 삼성서울병원 21건, 세브란스병원(17건) 등으로 빅5 병원들이 월등히 많았다.
연구개발 수탁전문기업(CRO)은 코반스코리아서비스유한회사 15건, 피피디디벨럽먼트피티이엘티디 15건, 한국파렉셀주식회사 13건 순으로 조사됐다.
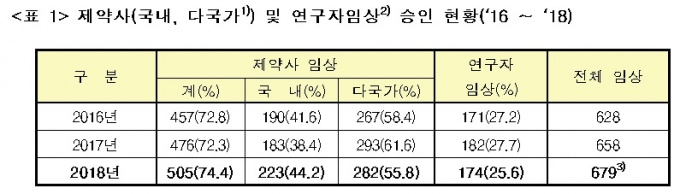
지난해 의약품 전체 승인은 679건으로 2016년(628건) 대비 8.1% 증가해 임상시험 승인 증가세가 지속되고 있는 것으로 나타났다.
전체 의약품 임상시험 승인은 2016년 628건, 2017년 658건, 2018년 679건으로 꾸준히 증가세를 보였다. 이 기간 전 세계 임상시험은 2016년 8090건, 2017년 7865건, 2018년 8386건으로 등락을 반복했다.
특히 지난해 임상시험 주요 특징은 ▲승인 건수의 꾸준한 증가 ▲국내에서 진행하는 초기단계 임상시험 증가 ▲중증질환 및 희귀난치성 질환 대상 임상시험 증가 등이다.
식약처는 "지난 2002년 임상시험 승인 제도 도입 이후 2003년 143건에 불과하던 승인 건수는 약 4.7배 증가했다"며 "이는 활발한 신약 개발 추세와 더불어 국내 임상시험 역량이 향상된 결과"라고 설명했다.
구체적으로 보면 의약품 개발 등을 목적으로 하는 ‘제약사 임상시험’ 승인 건수는 505건으로 2017년(476건) 대비 6.1% 늘어났다.
특히 초기단계인 제1상 임상은 2017년(176건) 대비 19.9% 늘어 큰 폭으로 증가했다. 지난해 승인된 제1상 임상시험 211건 중 국내에서만 실시하는 임상은 161건으로 76.3%에 달했다.
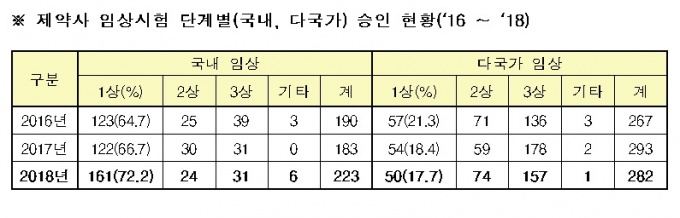
제1상 임상시험 161건 중 24.2%(39건)가 신약개발을 위한 임상시험으로, 그 중 국내 기업이 진행하는 임상시험이 94.9%(37건)에 달해 대부분을 차지했다.
이와 같이 국내 기업이 주도하는 신약개발을 위한 제1상 임상시험의 저변 확대는 국내에서 초기단계 의약품 개발이 활발하게 진행되고 있는 것으로, 이는 높아진 국내 제약산업의 신약 개발 역량을 나타낸다.
중증질환 및 희귀난치성 질환 대상 임상시험도 늘었다.
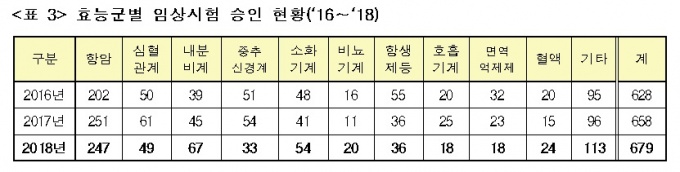
임상시험을 효능군 별로 살펴보면 항암제(247건), 내분비계(67건), 소화기계(54건), 심혈관계(49건) 등의 순으로 많았다.
대표적인 중증질환인 암 치료제를 개발하는 항암제 임상시험은 전체 임상시험의 36.4%를 차지하고 있으며, 3년 연속 가장 높은 비율을 차지하고 있다.
전체 승인 건수 대비 항암제 임상시험 비율은 2016년 32.2%에서 2017년 38.1%, 2018년 36.4% 등으로 증가했다.
항암제는 작용 기전별로 표적항암제가 111건(45.0%)으로 가장 많았고 면역항암제(92건, 37.2%)가 뒤를 이었다.
표적항암제 임상시험 111건 중 63.1%(70건)가 신약 개발을 위한 임상시험이었으며, 면역항암제 임상시험 92건 중 12.0%(11건)가 신약 개발을 위한 임상시험으로 나타났다.
소화기계 임상시험은 54건으로 2017년(41건) 대비 높은 증가율(24.4%)을 보였다. 특히 희귀질환으로 만성 염증성 장질환인 크론병 치료제 임상시험이 전년 대비 2배 이상 늘어난 추세가 두드러졌다.
대표적인 희귀질환인 혈우병에 대한 임상시험은 2017년 1건에 불과했으나 2008년에는 6건이 승인을 받았다. 희귀난치성질환은 규모가 작아 임상시험도 많지 않지만 조금씩 늘어나는 경향을 보이고 있다.
식약처 관계자는 "앞으로 희귀난치성 질환에 대한 치료기회를 확대하고 국가 신약개발 역량을 향상시켜 우리나라가 제약바이오산업 선도국가로 자리매김할 수 있도록 디딤돌 역할을 할 것으로 기대한다"고 밝혔다.
2018년 의료기기 임상시험, 전년과 비슷한 88건 승인
한편, 식약처는 의료기기 임상시험 승인 결과도 발표했다. 2018년 임상시험계획 승인 건수는 총 88건으로 전년 대비(84건) 비슷한 수준이었다.
승인된 의료기기 임상시험 가운데서는 뇌질환 개선을 위한 임상시험이 증가했으며 인공지능(AI) 기반 진단 의료기기, 의료용 로봇도 진행되는 등 분야가 다양해졌다.
치매환자의 기억력 개선, 뇌졸중 환자의 인지 기능 향상 등 뇌질환을 개선하기 위해 사용하는 의료기기 임상시험건수가 2017년 3건에서 2018년 10건으로 증가했다.
전기 자극을 통해 치매 치료에 도움을 주는 심리요법용뇌용전기자극장치가 7건이었으며, 범용유발성응답용자극장치, 치료용하전입자가속장치, 침전기자극기가 각각 1건이었다.
의사 진단을 보조하는 AI 적용 소프트웨어(의료영상검출보조소프트웨어, 의료영상진단보조소프트웨어 등)의 임상시험도 6건 있었다.
식약처는 “앞으로도 임상시험을 통해 의료기기 연구·개발이 활발히 이뤄질 수 있도록 관련 제도를 개선하고, 임상시험 참여자의 안전을 보장해 나갈 계획”이라고 밝혔다.
