[데일리메디 양보혜 기자] 지난해 국내 개발 허가 신약은 5개로 역대 최대를 기록했다.
식품의약품안전처(처장 김강립)는 지난해 의약품 허가·신고 현황을 담은 ‘2021년 의약품 허가 보고서’를 7일 발간했다.
작년 의약품 허가·신고된 품목은 총 2270개 품목으로, 완제는 1992개(87.7%), 원료는 83개(3.7%), 한약재는 195개(8.6%)다. 완제 가운데 전문의약품은 1542개(77.4%), 일반은 450개(22.6%)다.
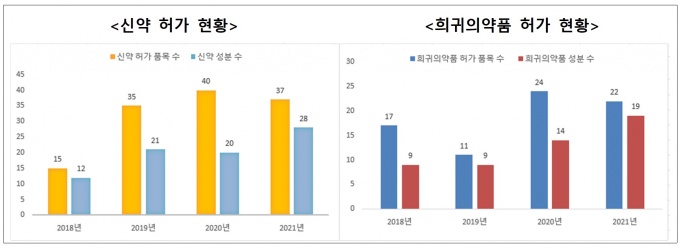
신약은 37개 품목(28개 성분)이 허가됐으며, 이중 국내 개발 신약이 5개 품목(5개 성분)으로 국산 신약 허가 품목 수를 집계하기 시작한 1999년 이후 최고치를 기록했다.
국산 신약 허가 수는 2018년 2개, 2019년과 2020년 0개, 2021년 5개다. 레이저티닙(유한양행), 레그단비맙(셀트리온), 에플라페그라스팀(한미약품), 백부근등 한약추출물(한림제약), 펙수프라잔(대웅제약) 등이 허가됐다.
희귀·난치성 환자의 치료 기회 확대를 위한 희귀의약품은 22개 품목(19개 성분)을 허가해 전년 수준을 유지했다. 2019년 11개 품목(9개 성분), 2020년 24개 품목(14개 성분), 2021년 22개 품목(19개 성분) 순이다.
코로나19 백신의 경우 6개(4개 성분)가 허가됐다. 작년 2월 한국아스트라제네카백스제브리아주(SK바이오사이언스)를 처음 허가했으며, 이 제품과 스파이크박스주(삼성바이오로직스)는 국내 제조로 허가했다.
또한 제네릭의약품 허가·신고 품목 수는 큰 폭으로 감소했다. 동일한 임상(생동)시험자료를 이용할 수 있는 품목 수를 3개로 제한하는 약사법 개정으로 약 41% 감소한 것.
실제 제네릭의약품 허가 수는 2018년 1625개, 2019년 4337개, 2020년 2613개, 2021년 1535개로 지속 하락세다. 허가한 280개 자료제출의약품 중 새로운 조성 의약품은 137개로 전체의 절반가량 차지했다.
그중 고지혈증 치료제(에제티미브 복합제)가 80개(58.4%)를 차지했고, 이는 고지혈증의 치료제 시장에서 제약업체 간의 경쟁이 매우 치열할 것으로 예상된다.
약효군별로 분류했을 때 ‘혈압강하제’ 등이 포함된 ‘순환계용 의약품’이 526개 품목으로 26.3%를 차지해 1위였다.
‘순환계용 의약품’은 전년(581개 품목, 18.7%)에 이어 1위를 차지한 것으로 전체에서 차지하는 비중은 7.6%p 증가했으며, 고령화 등 혈압약 시장의 지속적 확대에 따른 것으로 분석된다.
이어 ‘당뇨병용제 및 기타 대사성 의약품’ 387개 품목(19.4%), ‘신경계용 의약품’ 243개 품목(12.2%), ‘소화기관용 의약품’ 171개 품목(8.6%), ‘혈액 및 체액용약’ 168개 품목(8.4%), ‘알레르기용약’ 38개 품목(1.9%), ‘항생물질제제’ 20개 품목(1.0%) 순이다.
식약처는 "앞으로도 국내 의약품 업계의 연구·개발 지원을 위해 국내 의약품 허가·신고 현황과 분석 정보를 지속적으로 제공할 계획"이라고 밝혔다.


