변경된 유럽 의료기기 인증기준, 유예 요구 높아
의료기기협회 '유럽 MDR, 다른 나라들도 적응 시간 필요'
[데일리메디 한해진 기자] 올해부터 적용될 예정이던 유럽의 CE인증 내 의료기기규정(MDR)에 대한 유예 요구의 목소리가 높다.
한국의료기기산업협회 입민혁 산업지원부장은 최근 의료기기산업전문기자단과의 브리핑에서 "우리나라뿐만 아니라 해외 의료기기업계도 MDR에 적응할 시간이 필요해서 올해 바로 적용되기에는 어려움이 있다"고 밝혔다.
MDR은 프랑스에서 공업용 실리콘을 사용한 유방보형물 논란이 발생한 이후 의료기기 인허가를 엄격히 해야 한다는 취지에서 출발한 정책이다.
고유식별코드 적용 의무화나 기술문서 세분화, 규제항목 증가, 일회용품 원료 및 부품 재사용 규제 강화 등의 내용이 주요 골자다.
특히 업계의 애로사항은 MDR이 시행되면 현재 있는 의료기기 인증기관의 90%가량이 MDR에서 규정한 기준을 충족하지 못해 인증 업무를 할 수 없다는 점이다.
임민혁 부장은 "현재 CE인증 업무를 수행하는 기관이 150~180개소에 이르는데, MDR에서 적용하는 기준을 따르게 되면 인증 업무가 가능한 기관이 10%로 줄어든다"며 "사실상 CE인증이 불가능한 것"이라고 설명했다.
이어 "인증업무를 대행하는 컨설팅 기관에서도 아직 MDR 규정을 이해하는 전문가가 거의 없는 것이 현실"이라며 "유럽 측에 유예를 요청하려 한다"고 밝혔다.
또한 "우리나라뿐만 아니라 해외의 기업들도 상황이 비슷하다. 여러 국가에서 비슷한 요구가 있을 것으로 예상돼 올해도 유예될 가능성이 있다"고 덧붙였다.
이와 함께 협회는 MDR 시행에 따른 업체들의 구체적인 의견을 수집하기 위한 설문조사를 시행할 예정이다.
“올해 IMDRF 의장국 역할 충실히 수행할 것”
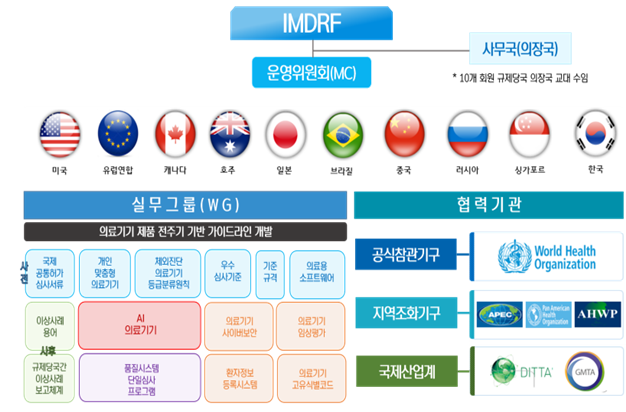
한편 우리나라는 올해 IMDRF(국제의료기기규제당국자포럼) 의장국으로써 대표자 역할을 수행하게 된다.
IMDRF는 의료기기 사전·사후 전주기에 대한 국제 규제조화 및 단일화를 촉진하기 위해 구성된 규제 당국자(미국·EU·캐나다·호주·일본·브라질·중국·러시아·싱가포르·한국)간 협의체다.
현재 한국 주도 IMDRF 인공지능(AI) 의료기기 실무그룹이 신설돼 가이드라인이 개발되고 있다.
또한 두차례 온라인 정기총회 및 원격회의를 개최, IMDRF에서 논의되는 모든 이슈를 관리하고 회원국 간 의견을 조율하는 역할을 할 예정이다.
임 부장은 “코로나19로 정기총회 규모를 축소해 온라인 상에서 개최하는 것에는 아쉬움이 남지만 식품의약품안전처와 산업계의 가교 역할을 충실히 수행하고 업계 지원에 노력하겠다”고 강조했다.