
[기획 上] 국내에서 항암제나 희귀의약품 개발을 하는 제약업체가 지속적으로 늘고 있다. 이들 분야의 경우 아직 치료제가 개발되지 않았거나 개발됐다고 해도 소수에 불과해 시장이 블루오션이라는 평가를 받고 있기 때문이다. 하지만 임상 3상까지 완전 종료하는 기간이 오래 걸리는 만큼 임상 2상을 마친 상태에서 허가를 해 주는 이른바 '조건부 허가제도'가 활용되고 있다. 조건부 허가 단서는 임상 3상 자료 제출을 전제로 하고 있지만, 실제로 조건부 허가 이후 10년째 자료를 제출을 하지 않은 업체도 있다. 이에 조건부 허가 제도를 개선해야 한다는 목소리가 높아지고 있는 상황이다. 실제로 금년 식품의약품안전처 국정감사에서도 이 사안이 제기됐다. 데일리메디가 국내서 이뤄진 조건부 허가 현황과 제도 개선 방향 등을 짚어봤다. [편집자주]
1) 조건부 허가 현황 및 3상 임상시험 자료 미제출 품목
2) 조건부 허가제도 개선 방향
 식약처는 항암제 등 중대질환 치료제 및 희귀의약품 등의 경우 3상 임상시험 자료를 별도 정하는 기간 내 제출하는 조건으로 의약품 판매를 허가해 주는 조건부 허가제도를 운영하고 있다.
식약처는 항암제 등 중대질환 치료제 및 희귀의약품 등의 경우 3상 임상시험 자료를 별도 정하는 기간 내 제출하는 조건으로 의약품 판매를 허가해 주는 조건부 허가제도를 운영하고 있다.
치료법이 어려운 환자들의 치료 접근성을 높이기 위해서라는 좋은 취지로 도입됐지만, 국내에서 운영이 부실하다는 지적을 받고 있다.
식품의약품안전처에 따르면 2012년부터 2021년까지 10년간 조건부 허가된 품목은 35개였다. 이 중 40% 가량인 15개 품목이 허가 당시 3상 자료 제출을 단서로 달았음에도 현재까지 임상시험 결과를 제출하지 않은 것으로 나타났다.
일부 품목은 임상시험이 진행 중에 있어 3상 자료 제출을 미룬 상태라고는 하지만 허가된 지 10년이나 자료 제출을 하지 않은 품목도 3개나 된다.
또 조건부 허가를 받아 놓고 실제 판매가 이뤄졌음에도 6개 품목은 3상 자료 제출 이전에 허가를 자진 취하하거나 취소되기도 했다.
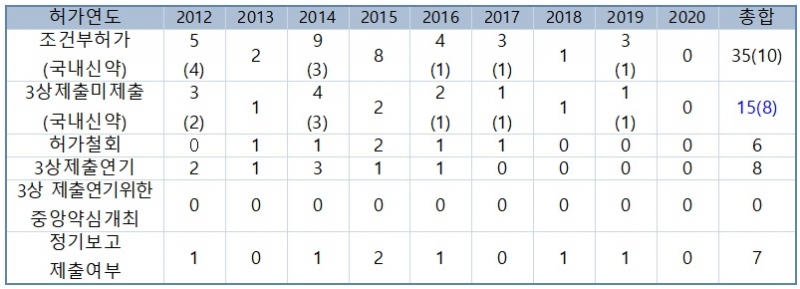
이는 최근 10년간 조건부 허가를 받은 의약품 가운데 80%는 임상시험 진행 현황조차 보고하지 않았다는 의미다.
리아벡스·올리타 등 2022년 국정감사에서도 문제 지적
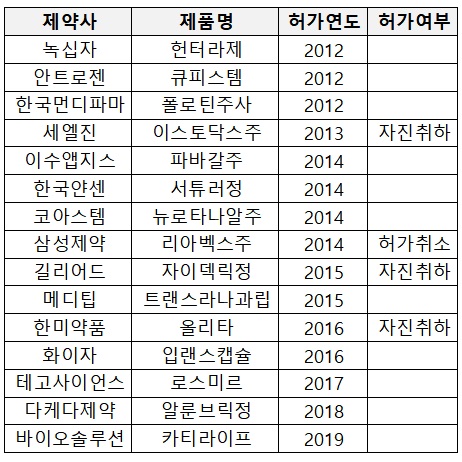 세부적으로 보면, 최근 10년간 조건부 허가에 따른 임상 자료를 제출하지 않은 업체와 품목은 ▲녹십자 '헌터라제' ▲안트로젠 '큐피스템주' ▲한국먼디파마 '폴로틴주사' ▲세엘진 '이스토닥스주' ▲이수앱지스 '파바갈주' ▲한국얀센 '서튜러정' ▲코아스템 '뉴로나타알주' ▲삼성제약 '리아백스주' ▲길리어드사이언스 '자이델릭정' ▲메디팁 '트랜스라나과립' ▲한미약품 '올리타정' ▲화이자 '입랜스캡슐' ▲테고사이언스 '로스미르' ▲다케다제약 '알룬브릭정' ▲바이오솔루션 '카티라이프' 등이다.
세부적으로 보면, 최근 10년간 조건부 허가에 따른 임상 자료를 제출하지 않은 업체와 품목은 ▲녹십자 '헌터라제' ▲안트로젠 '큐피스템주' ▲한국먼디파마 '폴로틴주사' ▲세엘진 '이스토닥스주' ▲이수앱지스 '파바갈주' ▲한국얀센 '서튜러정' ▲코아스템 '뉴로나타알주' ▲삼성제약 '리아백스주' ▲길리어드사이언스 '자이델릭정' ▲메디팁 '트랜스라나과립' ▲한미약품 '올리타정' ▲화이자 '입랜스캡슐' ▲테고사이언스 '로스미르' ▲다케다제약 '알룬브릭정' ▲바이오솔루션 '카티라이프' 등이다.
이 중 헌터라제와 큐피스템, 폴로틴주사 등은 허가된 지 10년이 경과됐으나 아직도 결과 보고서 제출이 완료되지 않았다.
세엘진 이스토닥스주를 비롯해 삼성제약 리아백스주, 길리어드사이언스 자이델릭정, 로슈 코텔릭정, 한미약품 올리타정, 릴리 라트루보주 등 6개 품목은 허가가 철회됐다.
금년 국정감사에서 국회 보건복지위원회 최종윤 의원은 조건부 허가제도 문제점을 질타했다.
당시 최 의원은 국내 제약사가 개발해서 조건부 허가를 받은 올리타와 리아벡스 사례를 꼬집었다.
최종윤 의원은 “안전성이 담보되지도 않은 시판된 약에 대한 3상 임상시험 연기를 중앙약심위를 단 한번도 거치지 않고 투명하지 않게 연장한 것이 문제”라며 "전문가들도 효과가 없다고 평가했던 췌장암 치료제인 리아백스가 조건부 허가를 받은 것도 중앙약심위를 거쳤더라면 문제를 사전에 인지할 수 있었을 것”이라고 강조했다.
이어 "조건부 허가 품목중 폐암치료제인 올리타는 3상 임상시험 중 부작용이 발견됐음에도 이를 숨겨 주식 시장 교란을 가져온 사례도 있다"며 "결국 한미약품은 개발 포기후 허가를 철회했다"고 덧붙였다.
조건부 허가, 임상 3상 자료 제출 기한은 무한대 인정?
조건부 허가 품목에 임상시험 결과보고서 제출이 늦어지는 이유 중 하나는 사실한 제출 기한이 정해져 있지 않다는 데 있다.
식약처 규정에는 임상시험 계획서만 제출토록 하고 있는데, 제약회사가 정한 기간보다 제출 기한이 연기가 될 경우 식약처가 내부 논의와 자문을 거쳐 기한을 연장해주고 있다.
실제 조건부 허가를 받은 품목 중 3상 자료를 제출하지 않은 업체의 기한 연장 사례를 보면 ▲임상참여 대상자 모집 지연 ▲추적조사 완료 시점을 고려한 제출 기한 연기 ▲임상시험 계획서 변경에 따른 기간 연장 등이 주요 이유였다.
시민단체에서도 조건부 허가 의약품에 대한 검증 필요성 강화를 주장하고 있다.
건강사회를위한약사회는 “조건부 허가 의약품은 아직 임상적 유용성이 검증되지 않았다”며 “식약처는 환자 안전관리를 위해 임상시험 자료를 제때 제출하지 않은 의약품에 대해 행정처분을 강화해야 한다”고 주장했다.
