[데일리메디 양보혜 기자] 식품의약품안전처(처장 이의경)는 14일(현지시각) 벨기에 브뤼셀에서 유럽연합(EU)이 이사회를 열고 우리나라를 7번째로 'EU 화이트리스트(GMP 서면확인서 면제)'에 등재했다고 밝혔다.
이 제도는 유럽으로 원료의약품을 수출하고자 하는 국가에 대해 제조·품질관리기준(GMP) 운영 현황을 직접 평가해 EU와 동등한 수준으로 인정되는 경우 원료의약품 수출 시 요구하던 GMP 서면확인서를 면제해준다.
이에 따라 EU에 수출하는 원료의약품의 경우, 국내 제약사는 GMP 서면확인서 면제로 수출을 위한 소요시간이 약 4개월 이상 단축될 것으로 예상된다. 현재 스위스, 호주, 일본, 미국, 이스라엘, 브라질 6개국이 등재돼 있다.
식약처 관계자는 "국내 원료의약품 GMP 운영체계나 국내 제약사의 원료의약품 품질이 EU뿐 아니라 미국, 일본 등 제약 선진국과도 동등한 수준임을 전 세계적으로 인정받게 됐다"고 설명했다.
이어 "이번 화이트리스트 등재는 지난 2014년 가입한 의약품실사상호협력기구(PIC/S)에 이어 다시 한 번 우리나라 제약산업의 글로벌 시장 진출의 기폭제가 될 것으로 기대한다"고 덧붙였다.
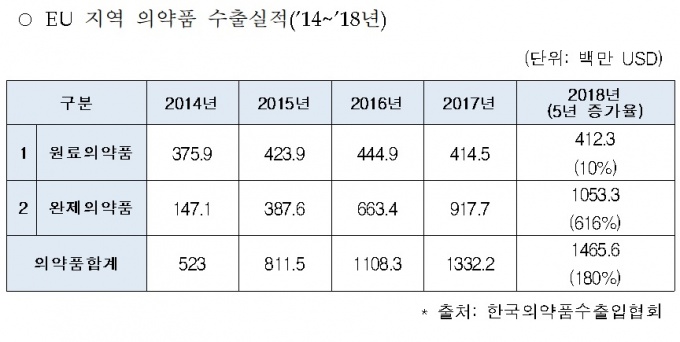
실제 의약품 GMP의 국제기준을 수립 및 주도하는 유일한 국제 협의체인 PIC/S 가입 후 수출액이 2014년 24억200만 달러에서 2018년 26억6600만 달러로 94% 상승한 바 있다.
직접적으로는 미국 다음으로 의약품 시장규모가 크고 국내 의약품 수출액의 31%를 차지하고 있는 EU를 중심으로 수출이 확대되고 관련 산업이 성장할 것으로 예상된다.
EU의 경우 의료보장비용 절감 등을 이유로 제네릭 의약품을 확대하는 상황에서 국내 제약산업에서 높은 비중을 차지하는 제네릭 의약품의 원료의약품 생산업체에 수출 호재가 될 것으로 관측된다.
아울러 장기적으로 제네릭 의약품을 중심으로 시장이 형성돼 있는 러시아 등 독립국가연합(CIS)이나 최근 의약품 분야 국가 간 협력이 강화되고 있는 베트남 등의 아세안시장 진출도 기대된다.
식약처는 "이번 EU 화이트리스트 등재가 신청서 제출(2015년 1월) 이후 전담 대응팀을 중심으로 4년여 간 치밀하게 현장평가와 평가단 면담 등 심사절차에 대응한 결실"이라며 "앞으로도 국산 의약품 경쟁력에 기반한 글로벌 시장 진출 확대를 위해 국가 간 협력을 강화하고 각종 국제협의체 활동에 적극 참여하겠다"고 밝혔다.

 실제 의약품 GMP의 국제기준을 수립 및 주도하는 유일한 국제 협의체인 PIC/S 가입 후 수출액이 2014년 24억200만 달러에서 2018년 26억6600만 달러로 94% 상승한 바 있다.
실제 의약품 GMP의 국제기준을 수립 및 주도하는 유일한 국제 협의체인 PIC/S 가입 후 수출액이 2014년 24억200만 달러에서 2018년 26억6600만 달러로 94% 상승한 바 있다. 