 점안제를 비롯해 점이제, 폐흡입제, 외용제제 322개 품목을 대상으로 의약품 동등성 재평가를 실시한 결과, 54개 품목이 취하 대상에 올랐다.
점안제를 비롯해 점이제, 폐흡입제, 외용제제 322개 품목을 대상으로 의약품 동등성 재평가를 실시한 결과, 54개 품목이 취하 대상에 올랐다.
허가 취하 대상에는 한때 ‘기적의 크림’으로 불렸던 트레티노인 성분 광노화 치료제 연고 14개 품목도 포함됐다.
식품의약품안전처는 금년 2월 안전성과 유효성이 확보된 의약품 공급을 위해 시중 유통 의약품 중 2021년 10월 공고한 4종 품목 재평가 결과를 공개했다.
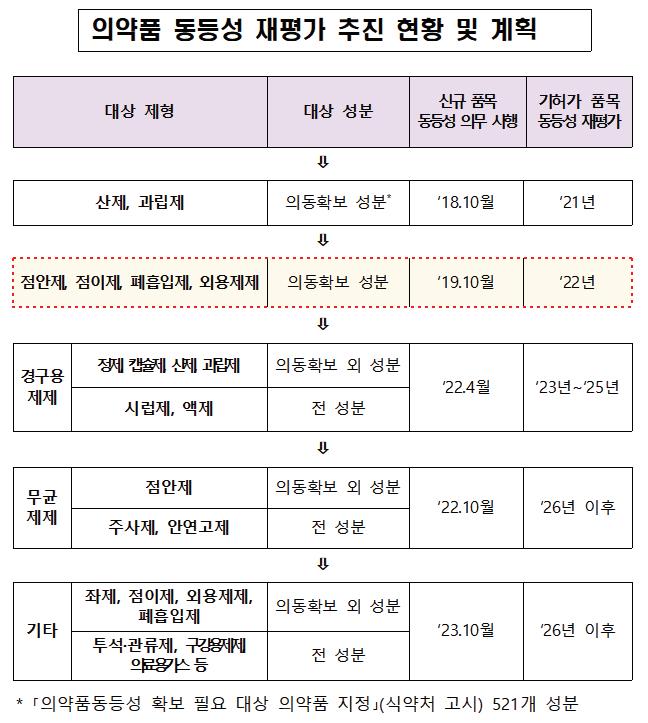
의약품 동등성 평가는 주성분·함량 및 제형이 동일한 두 제제에 대한 의약품 동등성을 입증하기 위해 실시하는 생물학적 동동성, 비교용출(주성분과 투여 경로가 같은 두 제제에 대해 같은 조건에서 용출 양상을 비교하는 시험) 등을 시험한다.
업체 요청으로 자료보완 기간이 주어진 36개 품목을 제외한 286개 품목의 재평가 결과가 공개됐다.
그 결과 105개 품목은 재평가 공고에 따라 의약품 동등성을 입증했고, 54개 품목은 취소되거나 자진 취하됐다.
나머지 127개 품목은 공고 전(前) 제출한 자료로 동등성 입증 및 대조약 지정, 생물학적 동등성 인정을 받았다.
트레티노인 등 취하 품목 ‘외용제’
이번 재평가에서 허가 취소되거나 자진 취하한 54개 품목 가운데 국내 제조 품목은 43개로 집계됐다. 종류별로는 외용제제 38개, 점안제 12개, 폐흡입제 2개다.
탈락 품목이 가장 많은 외용제를 성분별로 보면 트레티노인(14개), 부데소니드(7개), 에리트로마이신(3개) 순이었다.
14개 품목이 허가 취하된 트레티노인은 비타민A를 활성화시키는 성분으로 피부표면의 각질층을 벗겨내 거친 피부를 회복하게 하고, 콜라겐을 생성하는 광노화 치료제다.
과거 TV프로그램에서 주름과 여드름을 없애고, 젊은 피부로 되돌아가게 해주는 ‘기적의 크림’으로 부각된 바 있다.
대표 품목으로 꼽히는 갈더마코리아의 ‘레타크닐크림’, 태극제약 ‘아지나크림’, 동성제약 ‘이노바에이크림’등이 이번 평가에서 탈락했다.
태극제약의 경우 외용제제 8개 품목이 무더기로 허가 취소됐다. 트레티노인 성분 아지나크림 등 5개 품목과 여드름 치료 항생제 연고인 에이신에스겔 성분 3개 품목 등이다.
이 외 알리코제약 ‘리바스티렌패취5’, 명문제약 ‘베베크림’, 에이프로젠제약 ‘부데손크림·트레틴크림0.05%’, 비보존제약 ‘제크크림’, 갈더마코리아 ‘로섹스크림0.75·실키스연고·트리루마크림’, 일성신약 ‘본알파로오숀·본알파크림·본알파하이연고’, 나노팜 ‘프로좀에이크림0.05%, 제뉴원사이언스 ‘이크림0.025%·이소마이겔’, 제이더블유신약 ‘데소니드연고’, 동구바이오제약 ‘후시타손크림·라소니드연고’, 동성제약 ‘이노바에이크림0.025%, 위더스제약 ‘이소티노인겔’ 등이다.

레보플록사신수화물 제제 등 점안제 재평가 ‘탈락’
최근 미국에서 점안제 사용 후 녹농균에 감염된 사건이 발생하면서 큰 관심을 모은 점안제 재평가 결과, 12개 품목이 취하됐다.
대표 품목으로는 레보플록사신수화물 제제인 제일약품 ‘엘플록스점안제’, 제이더불유신약 ‘제일플로점안제’, 비보존제약 ‘아이덱신점안제’ 등이 있다.
제일약품 엘플로스점안액의 경우 지난 2013년 허가됐으며 안검염, 맥립종, 누낭염, 결막염, 검판선염, 각막염, 각막궤양, 안과 수술시 무균화요법 등에 사용된다.
제이더블유신약의 제이플로점안액도 동일한 적응증을 가졌지만, 지난 2021년 10월 취하됐다.
바이넥스 ‘클낙점안액·알레놀디점안액0.2%’, 넥스팜코리아 ‘이레보점안액·퀴록신점안액·아젤라스틴포스점안액’, 대한약품공업 ‘디페낙점안액’, 비보존제약 ‘아이덱신점안액’, 휴온스메디케어 ‘리솝점안액’, 씨엠지제약 ‘루체디티점안액’, 이연제약 ‘옵티페낙점안액’, 인트로바이오파마 ‘목시아이점안액0.5%’ 등도 취하 목록에 포함됐다.
식약처는 신규 허가 시 ‘동등성 입증 자료 제출’ 대상이 확대됨에 따라 이전에 허가된 품목에 대한 동등성 재평가를 순차적으로 실시하고 있다.
향후 2025년까지 캡슐제·시럽제 등 경구용 제제 재평가를 완료하고, 2026년 이후 무균 제제와 나머지 기타 제제을 대상으로 재평가를 실시할 계획이다.
식약처 관계자는 "이번 재평가 결과 공개가 국내 유통 중인 의약품에 대한 신뢰성을 높이는데 도움이 될 것으로 기대한다"며 "국민이 안심하고 효과성과 안전성이 확보된 의약품을 사용할 수 있도록 노력하겠다"고 밝혔다.
아세틸엘카르니틴·옥시라세탐 등 효능 입증 ‘실패’
한편, 식약처는 의약품 동등성 재평가와 함께 임상시험 재평가도 실시하고 있다.
임상시험 재평가는 의약품 허가 기준이 상대적으로 미비했던 시절 심사를 통과한 약제들을 대상으로, 현재의 과학기술로 유효성·안전성을 재입증하는 것이다.
문제는 심사대에 올랐던 약제들이 줄줄이 관문을 통과하지 못했다는 점이다. 다수가 적응증 축소 혹은 부분 삭제, 나아가 완전 삭제되는 운명에 처했다.
예컨대 아세틸엘카르니틴, 옥시라세탐 등 중추신경계(CNS) 제제들이 줄줄이 퇴출 수순을 밟게 됐다. 이에 심사대에 오를 차기 주자에 대해 제약업계의 관심이 높다.
식약처 의약품안전평가과 신경승 과장은 "현재 11개 제제가 임상 재평가 계획에 따라 유효성 입증을 위한 임상시험을 실시하고 있다"고 밝혔다.
평가 약제는 날록손염산염, 지페프롤염산염, 스토렙토키나제·스토렙토도르나제, 세프테졸나트륨, 콜린알포세레이트, 디히드록시디부틸에테르, 포르모테롤푸마르산염수화물, 알긴산카르복시메틸셀룰로오스, 케노데옥시콜산우르소데옥시콜산삼수화물마그네슘염, L-아스파르트산-L-오르니틴(엘-아스파르트산-엘-오르니틴), 포도당·염화나트륨·시트르산칼륨수화물·시트르산나트륨수화물 등이다.
이중 날록손염산염, 세프테졸나트륨 등 일부 제제의 경우 임상재평가 결과 자료 제출 기한이 가까워진 것으로 알려졌다.
신 과장은 "업체가 임상 기간 연장을 1회 요청할 수 있어 임상 재평가 결과 발표까지는 시간이 더 소요될 수 있다"며 "일각에서 재평가 기간이 너무 긴게 아니냐는 지적이 있는데, 모든 동일하게 적용하는 것이 아니라 약제 특성을 반영한 것"이라고 덧붙였다.
[위 내용은 데일리메디 오프라인 봄호에서도 볼 수 있습니다]
