2018년 美FDA 문턱 넘을 국내신약 6개 추정
증권계, 녹십자·SK바이오팜·대웅·삼성·셀트리온 등 거론
올해 미국 식품의약국(FDA)의 관문을 통과할 국내 신약이 최대 6개까지 집계됐다. 미국 시장 진출은 제약바이오기업의 경쟁력을 가늠하는 척도인 만큼 업계의 관심이 높다.
9월 증권업계에 따르면 미국 시장 진출을 위해 FDA 허가 신청을 완료하고 결과를 기다리는 국내 의약품이 6개 정도인 것으로 확인됐다.
구체적으로 △나보타(대웅제약) △IVIG-SN(녹십자) △SKL-N05(SK바이오팜) △온트루잔트(삼성바이오에피스) △트룩시마(셀트리온) △허쥬마(셀트리온) 등이다.
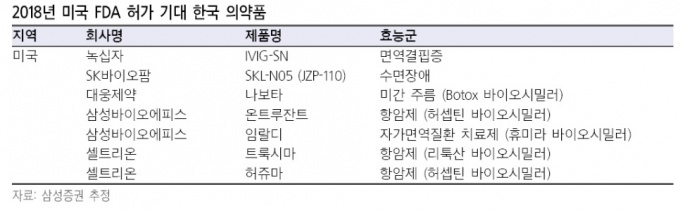
삼성증권 제약 담당 연구원은 "지금까지 미국 FDA 허가를 받은 국내 제약, 바이오의약품은 8개에 불과하다"며 "하지만 올해 FDA 허가가 기대되는 의약품이 6개에 달하는 만큼 시장 전망이 밝다"고 관측했다.
특히 도널드 트럼프 미국 정부가 신약 승인 관련 규제를 대폭 완화하면서, 올해 신약 허가 건수가 사상 최대치를 기록할 것이라는 분석도 나오고 있다. 실제 이밸류에이트파마 자료에 따르면 2016년 FDA 신약 허가 건수는 27건으로 2017년에는 46건으로 19건 증가했다.
바이오시밀러 '램시마'로 미국 시장에 진출한 셀트리온은 후속 바이오시밀러인 '트룩시마(항암제 리툭산)'와 '허쥬마(유방암 항암제 허셉틴)'로 다시 한 번 미국 시장 공략에 나선다.
셀트리온 관계자는 "트룩시마는 지난해 6월, 허쥬마는 지난해 7월에 품목허가를 신청했으며, 올해 허가가 날 것으로 기대한다"며 "다만, 오리지널 약인 허셉틴의 특허가 내년 6월까지 유효해 특허가 만료돼야 출시된다"고 말했다.
녹십자와 대웅제약도 미국 시장 진출을 목전에 두고 있다. 녹십자는 면역증강 혈액제제 ‘아이비글로불린-에스엔(IVIG-sn)’, 대웅제약은 주름개선제인 보툴리눔톡신 ‘나보타’에 대한 미 FDA 허가심사를 진행하고 있다.
녹십자와 대웅제약 관계자 모두 "증권업계의 전망처럼 올해 FDA허가가 나면 좋겠지만, 워낙 까다롭기로 유명하기에 일단은 기다려봐야 한다"고 말했다.
반면, 삼성바이오에피스는 지난해 12월 미국 FDA에 바이오시밀러 온트루잔트(항암제 허셉틴)의 판매 허가를 신청했다. 이에 업계의 예상처럼 올해 안에 허가 승인이 나기 어렵다는 관측을 내놨다.
이에 대해 삼성바이오에피스 관계자는 "통상 FDA 의약품 허가 승인에 13~14개월정도 걸리기 때문에 내년 상반기에 결과가 나오지 않을까 생각한다"며 "증권업계 바람대로 되면 우리도 좋겠다"라고 말했다.

