 [데일리메디 양보혜 기자] 골괄절염치료제 '인보사'가 글로벌 의약품 매출 10위권 내 진입을 위한 미국 임상 3상에 들어간다.
[데일리메디 양보혜 기자] 골괄절염치료제 '인보사'가 글로벌 의약품 매출 10위권 내 진입을 위한 미국 임상 3상에 들어간다.
이번 임상은 통증 및 기능 개선을 넘어 '근본적 치료제'로서 가치를 인정받기 위해 진행된다.
10일 이우석 코오롱티슈진 대표이사(사진)는 서울 코오롱 One& Only 타워에서 열린 ‘인보사 미국 3상 돌입 및 국내 허가 1주년 기자 간담회’에서 이 같은 포부를 밝혔다.
이 회장은 “임상 시료 준비가 안 돼서 홀드(hold)돼 있던 인보사 미국 임상 3상을 식품의약국(FDA)로부터 7월 3일 허가 받았다”며 “미국 임상 3상은 대량생산을 위한 시판이 가능한 상태로 제조 프로세스를 갖춰야 하기 때문에 임상 2상과 조금 다르다”고 말했다.
이어 그는 “이틀 전 FDA로부터 '매우 만족스럽게 일시 정지된 의학적 이슈를 해결(satisfactorily addressed all clinical hold issues)해서 임상 3상을 진행해도 된다'는 승인 레터를 받았을 때 무척 기분이 좋았다“며 “이제는 더 이상 걸림돌이 없다”고 강조했다.
미국 임상 3상은 올해 7월부터 10월까지 미국 내 임상기관 등록을 진행하고, 이후 2021년 8월까지 1020명 환자를 대상으로 약물 투약 및 관찰기간을 갖는다.
3년간 환자 관찰을 마무리한 뒤 2021년 8~9월부터 데이터 분석을 통해 2021년 4월까지 품목허가 신청을 완료할 계획이다.
이번 임상 3상에는 글로벌 기업들이 대거 참여하며, 존스홉킨스, 로스만병원 등 55여개 주요 거점병원에서 임상이 진행된다.
글로벌 임상시험수탁기관(CRO)인 파렉셀(Parexel), MRI/x-ray업체 chondrometrics, BICL, 바이오마커업체 노리딕바이오사이언스, 데이터분석업체 메디데이터 등과 파트너십을 구축한다.
이 대표이사는 “미국 인보사 3상은 연골이 남아있는 K&L 2등급이 포함돼 그 효과가 더 잘 입증할 것으로 기대한다”며 “통증완화, 기능개선, 구조개선 등을 통해 식약처 가이드라인이 명시된 근본적 골좐절염치료제(DMOAD)로서 인정 받아 환자들의 삶의 질 개선에 기여할 것으로 기대된다”고 말했다.
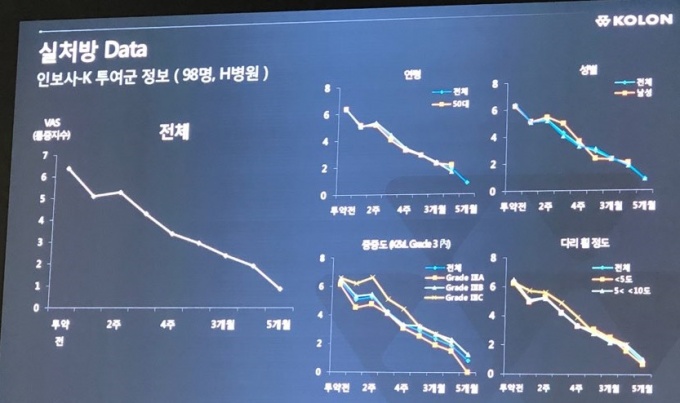 그는 이어 “인보사는 미충족 수요가 있는 시장을 공략해 시장성이 높고, 대량생산이 가능하다”며 “약가는 비싸지만 부작용이 없고, 2년 이상 약효가 지속돼 질환의 진행속도를 늦출 수 있는 혁신적인 의약품으로 차별화된 경쟁력을 갖추고 있다”고 설명했다.
그는 이어 “인보사는 미충족 수요가 있는 시장을 공략해 시장성이 높고, 대량생산이 가능하다”며 “약가는 비싸지만 부작용이 없고, 2년 이상 약효가 지속돼 질환의 진행속도를 늦출 수 있는 혁신적인 의약품으로 차별화된 경쟁력을 갖추고 있다”고 설명했다.
실제 미국의 L.E.K 자료에 따르면 인보사는 통증 및 기능 개선만으로 미국에서 32억 달러(3조 5657억원)의 시장가치를 갖는다.
여기에 DMOAD 라벨까지 획득한다면 22억 달러(2조 4514억원)로 가치가 더 높아진다.
이석우 대표는 "인보사는 국산 신약으로는 처음 글로벌 시장 톱 10에 진입하는 품목으로 자리잡을 것"이라며 "경쟁 약물이 없는 인보사의 10년 후 글로벌 시장 연간 매출은 10조원으로 추정된다"고 힘줘 말했다.
이어 그는 "현재 세계 시장에서 제일 많이 처방되는 의약품이 휴미라인데, 매출이 18조원"이라며 "인보사는 세계 10위, 아니 글로벌 넘버 2위로도 발돋움할 수 있도록 최선을 다할 것"이라고 덧붙였다.
