
지아이이노베이션 관계사 지아이셀이 차세대 항암 병용요법 안전성 및 유효성을 평가하기 위한 병용 임상1/2a상 신청서를 식약처에 제출했다고 2일 밝혔다.
임상은 재발성/불응성 고형암 환자를 대상으로 지아이셀 동종유래 NK세포치료제 'T.O.P. NK'와 지아이이노베이션 차세대 면역항암제 'GI-101A' 병용요법 안전성·유효성 평가에 나선다.
'T.O.P. NK'는 대량 배양이 가능하고 종양 타깃능과 암세포 살상효율을 극대화한 차세대 NK세포치료제로, 현재 재발성/불응성 고형암 및 혈액암 환자를 대상으로 진행 중인 단독요법 임상 1상에서 우수한 효능을 보여주고 있다.
지아이셀은 임상 1상 중간 결과에서 표준 치료에 실패한 비호지킨 림프종 환자에 T.O.P. NK를 3회 투약 후 첫 번째 종양평가를 수행한 결과 완전관해(CR)를 확인했다.
여기에 최소 3번의 표준치료에 실패한 4명의 직장암 환자 중 3명에서 6개월 이상 투약이 진행되었으며 이중 2명에서는 종양이 감소하는 안정적병변(SD)을 확인했다.
지아이셀은 NK세포치료제의 단독요법 임상임에도 재발성 림프종에서 강력한 효능을 확인하고, 직장암의 3차 표준치료제의 무진행 생존기간(mPFS)이 약 2개월인 점을 고려하면 직장암에서도 고무적인 결과를 나타냈다는 설명이다.
GI-101A는 ‘CD80’과 ‘IL-2 변이체’ 기능을 동시에 가진 이중융합단백질로 IL-2부위는 면역세포의 증식 및 활성화에 관여하고, CD80은 암세포를 공격하는 면역세포를 억제하는 수용체인 CTLA4를 차단하는 역할을 한다.
현재 면역항암제 키트루다와 병용요법으로 국내와 미국에서 임상 1/2상 진행 중이다.
해당 임상에서 GI-101A가 면역항암제에 내성이 있는 암환자의 면역세포를 무진행 생존기간을 현저히 증가시킴을 확인한 바 있다. 향후 추가 협업을 통해 GI-102 병용요법 임상도 돌입할 예정이다.
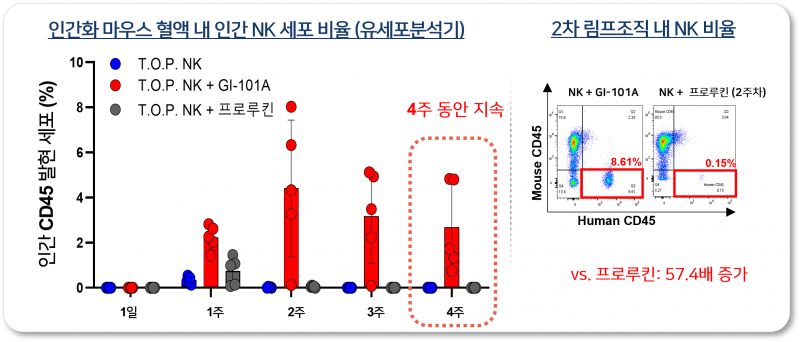
회사 측은 비임상 시험에서 GI-101A 또는 GI-102와 T.O.P. NK의 병용투여 시, T.O.P. NK의 체내 지속성이 유지되고 T.O.P. NK 단독투여 대비 항암효능이 증가함을 확인했다는 설명이다.
지아이셀은 이러한 결과를 토대로 GI-101A/GI-102와의 병용요법에서 T.O.P. NK의 투여 용량을 단독요법 대비 수배에서 수십배 낮춤으로써 상업성을 극대화할 수 있을 것으로 기대하고 있다.
장명호 지아이셀 최고임상과학고문은 “첨생법 개정안의 국회 본회의 통과로 말기암 환자뿐만 아니라 초기암 및 수술 후 환자분들도 세포∙유전자 치료를 받을 수 있는 길이 열렸다”며 “병용 개발을 통해 더 많은 환자분들이 혜택을 보실 수 있도록 최선을 다할 것”이라고 말했다.
