[데일리메디 백성주 기자] 위궤양 및 역류성 식도염 치료제의 주원료로 사용되는 라니티딘 성분 의약품 제조·수입·판매 처방 중지 조치에 따라 제약사들이 비상이 걸렸다.
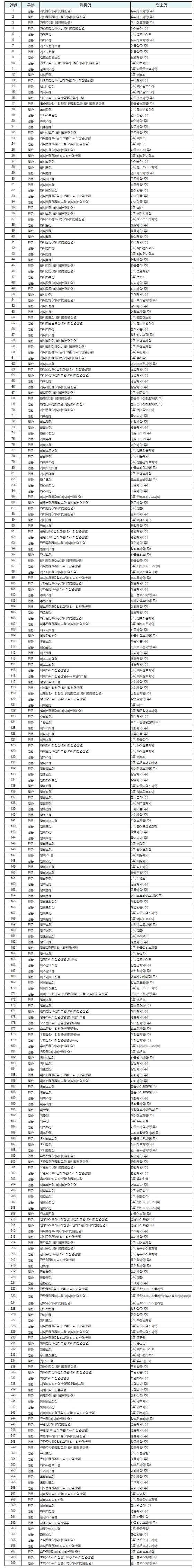
식품의약품안전처는 26일 국내 유통 중인 ‘라니티딘 성분 원료의약품’ 7종에서 암 유발 물질인 NDMA가 잠정관리기준(0.16ppm)을 초과해 검출됐다고 밝혔다.
이어 식약처는 국내 유통 중인 라니티딘 원료의약품 7종과 이를 사용한 완제의약품 269품목 전체에 대해 잠정적으로 제조·수입·판매 중지 및 회수 조치하고, 처방을 제한토록 했다.
보건당국은 26일부터는 해당 의약품이 병‧의원, 약국에서 처방‧조제되지 않도록 건강보험심사평가원 의약품안전사용정보시스템(DUR)을 통해 처방・조제를 차단하고, 건강보험 급여 적용도 정지했다.
라니티딘 오리지널 제품 ‘잔탁’의 국내 판매사인 한국GSK는 발표에 앞서 유통 중단 결정을 내리는 등 제약사들은 대비에 나서는 모습이다.
실제 유한양행, 한미약품, 대웅제약, 녹십자, 일동제약, 제일약품, 보령제약, 안국약품, 광동제약을 포함한 국내를 대표하는 제약사 대부분은 해당 성분을 포함한 위궤양 및 역류성 식도염 치료제를 판매 중이다.
라니티딘 성분 단일제 시장점유율 1위인 ‘큐란’을 판매 중인 일동제약은 보건당국 발표와 조사결과를 예의주시하고 있다.
일동제약 관계자는 “우선 식약처 조치에 적극 협조할 계획”이라며 “추후 이뤄질 조사 결과를 기다리겠다”고 입장을 전했다.
지난해 기준 알비스로 500억원 이상의 매출을 올려 라니티딘 성분 단일제‧복합제 1위 제품을 보유한 대웅제약의 경우 신속한 대응책을 마련했다.
식약처 명령에 따라 오늘(26일) 날짜로 해당 제품에 대한 회수 및 폐기 등 필요한 조치를 빠르게 진행한다는 방침이다.
대웅제약 관계자는 “알비스를 포함한 관련 제품의 대체 제품을 선정, 투입해 매출 보완을 진행할 예정”이라며 “매출에 심각한 영향은 없을 것”으로 전망했다.
한국GSK는 본사 차원의 유통중단 조치를 수행중이다. 대상은 ‘Saraca laboratories’와 ‘Dr Raddy's’에서 공급된 모든 제품이다.
회사 관계자는 “국내는 ‘Saraca laboratories’에서 공급된 제품으로 유통중단 및 자진회수 대상”이라며 “식약처에 신청한 자진회수 조치 내용을 곧 발표할 예정”이라고 말했다.
그는 “식약처 우려를 존중, 조사결과와 무관하게 안전상에 우려가 되는 부분에 대해 선제적 공급중단을 수행해 나갈 것”이라고 강조했다.