
생물학적제제의 ‘사용상 주의사항’에 약물 이상반응은 물론 ‘이상사례’까지 기재 범위가 확대된다.
식품의약품안전처(처장 오유경)는 백신, 유전자재조합의약품 등 생물학적제제 등의 허가·심사 규제 합리화를 위해 '품목허가·심사 규정'을 개정했다고 17일 밝혔다.
생물학적제제는 사람이나 다른 생물체에서 유래된 원료 또는 재료로 제조한 의약품으로 보건위생상 특별한 주의가 필요한 의약품을 의미한다. 백신 및 혈장분획제제 등이 포함된다.
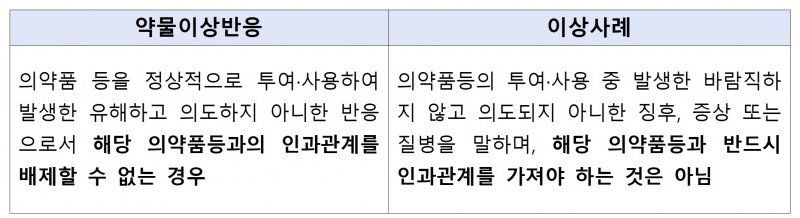
주요 내용은 ▲‘사용상 주의사항’에 ‘약물 이상반응’을 포함한 ‘이상사례’까지 기재 확대 ▲생물학적제제 완제의약품 ‘기준 및 시험방법’에서 ‘이상독성부정시험’ 삭제 등이다.
약물 이상반응과 달리 이상사례는 의약품 투여·사용 중 발생한 바람직하지 않고 의도되지 않은 징후 및 증상 또는 질병으로, 해당 의약품 등과 반드시 인과관계를 가져야 하는 것은 아니다.
또한 앞으로 생물학적제제 제조․수입업자는 완제의약품 ‘기준 및 시험방법’에 이상독성부정시험을 설정하지 않아도 된다.
‘이상독성부정시험’은 마우스나 기니피그에 생물학적제제를 투여해 제조 시 유입될 수 있는 외래물질로 인한 이상 반응이 나타나는지 7일 간 확인하는 시험이다.
제조·품질관리를 준수하면서 제조공정 중 외래물질 유입 가능성이 최소화됐고, 완제의약품 오염 여부를 확인하고 있어 이상독성부정시험을 삭제해도 안전성에 문제가 없는 것으로 판단했다.
식약처 관계자는 "앞으로도 과학적 지식과 규제 전문성을 바탕으로 품질이 확보된 생물학적제제등이 제품화될 수 있도록 최선을 다해 지원하겠다"고 말했다.
