
 최근 2년간 의약품 신속심사 지정 의약품은 총 23개로 집계됐다. 이중 17개 의약품이 품목 허가를 획득했다.
최근 2년간 의약품 신속심사 지정 의약품은 총 23개로 집계됐다. 이중 17개 의약품이 품목 허가를 획득했다.
식품의약품안전처가 최근 발간한 '의약품 신속심사 보고서'에는 2020년 8월 31일부터 2022년 7월 31일까지 최근 2년간 신속심사과의 업무 현황이 담겼다.
신속심사는 생명을 위협하는 질병 또는 희귀, 난치질환 치료제 등 혁신적 제품 및 공중보건 위기대응 의약품에 대해 환자의 신속한 치료 기회를 보장하기 위해 2020년 8월말부터 본격 도입됐다.
구체적으로 보면 신속심사 지정은 2020년 4품목, 2021년 11품목, 2022년 7월까지 8품목 등 총 23품목이다. 신속심사 신청은 25건이었으나, 자료 미흡 및 자진 취하로 2건은 지정되지 못했다.
2021년 신속심사 지정 의약품이 전년보다 증가한 것은 코로나19 펜데믹 상황에 발빠르게 대처하기 위한 코로나19 백신의 심사가 증가했기 때문이다.
국내 신속심사 지정 1호는 한국아스트라제네카 '셀루메티닙'과 혁신형 제약기업인 대웅제약 SGLT-2 억제제 당뇨신약 'DWP16001으로 2020년 10월 23일 동시에 지정됐다.
신속심사 지정 후 허가 완료된 품목은 화학의약품 5품목, 생물의약품 1품목, 코로나19 백신 10품목, 생약 1품목으로 총 17품목이다. 일반심사시간의 75% 이내에 심사 완료를 목표로 진행됐다.
약효군별로는 항악성종양제가 56.5%(13품목), 코로나19 치료제 및 백신 30.4%(7품목), 그 외 기타 품목으로 화학요법제 4.3%(1품목), 순환기계의약품 4.3%(1품목), 당뇨병용제 4.3%(1품목) 등이다. 신속심사 지정 품목 중 희귀의약품은 11품목으로 47.8%를 차지했다.
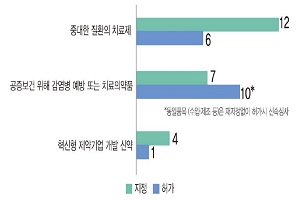
생명을 위협하거나 중대질환 치료제는 12품목, 공중보건 위해(危害) 감염병 예방 또는 치료 의약품은 7품목, 혁신형 제약기업 개발 신약은 4품목이다.
한국화이자제약 '코미나타주', 한국아스트라제네카 '코비드19백신주', 녹십자-모더나 '모더나코비드19백신주', 한국얀센 '리브리반트주' 등이 코로나19 백신 등이 대표적이다.
식약처는 "신속심사 대상으로 지정되면 신청자와 심사자는 허가심사 일정 사전계획 등 전반적인 심사 일정을 공유하고, 긴밀히 소통해왔다"며 "준비된 자료부터 심사하는 수시 동반심사를 실시해 30일 이내 업무를 처리했다"고 밝혔다.
