

경구용 급성 골수성 백혈병 치료제인 BMS의 '오뉴렉'과 노바티스의 ‘셈블릭스’가 건강보험 급여 적정성을 인정받았다.
건강보험심사평가원은 6일 '2023년 제4차 약제급여평가위원회(약평위)'를 열고 이같은 내용을 심의 및 의결했다.
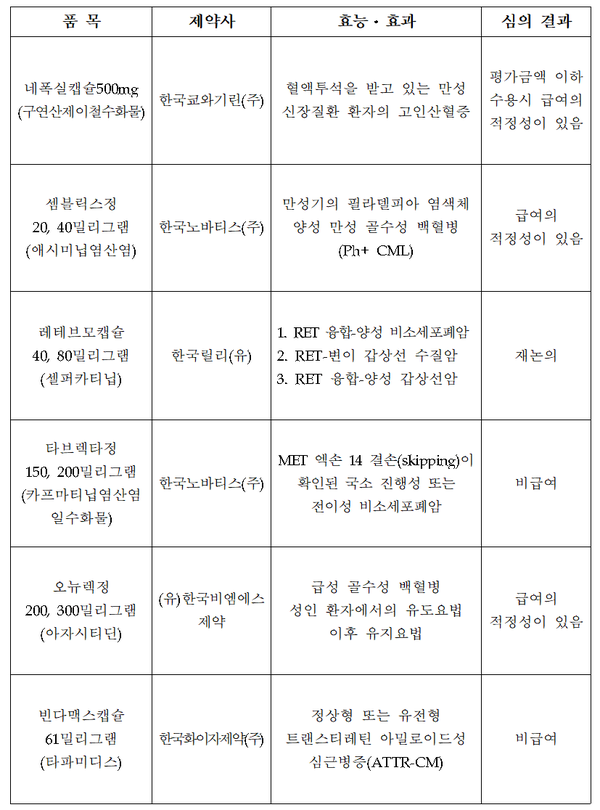
약평위는 우선 한국비엠에스제약의 오뉴렉정 200㎎·300㎎(아자시티딘)에 대해 급여 적정성이 있다고 평가했다.
오뉴렉은 '유도요법 이후 완전관해를 달성하고 조혈모세포이식(HSCT)이 적합하지 않은 AML 환자의 유지요법'에 사용되는 유일한 경구제다.
또한만성 골수성 백혈병 치료제인 한국노바티스의 셈블릭스정 20㎎·40㎎(애시미닙염산염)도 급여 적정성이 인정됐다.
셈블릭스정은 지난해 6월 식품의약품안전처 허가를 받았다.
셈블릭스와 오뉴렉은 약평위 통과 이후 국민건강보험공단의 약가협상을 거쳐 건강보험정책심의위원회를 거쳐 급여의약품으로 등재될 전망이다.
혈액투석을 받는 만성 신장질환 환자의 고인산혈증을 개선하는 치료제인 한국쿄와기린의 네폭실캡슐 500mg(구연산제이철수화물)은 평가금액 이하 수용시에 급여 적정성이 있다고 평가됐다.
RET(Rearranged during transfection) 표적 항암제 신약인 한국릴리의 레테브모캡슐 40㎎·80㎎은 급여 적정성 인정에 대해 재논의하기로 했다.
하지만 한국노바티스의 비소세포폐암 치료제 ‘타브렉타정’ 150㎎·200㎎(카프마티닙염산염일수화물), 한국화이자제약의 아밀로이드 심근병증 치료제 ‘빈다맥스캡슐’ 61㎎(타파미디스)는 비급여로 평가돼 급여권 진입이 불투명해졌다.

BMS '' .
6 '2023 4 ()' .
200300() .
' (HSCT) AML ' .
2040() .
6 .
.
500mg() .
RET(Rearranged during transfection) 4080 .
150200(), 61() .


