
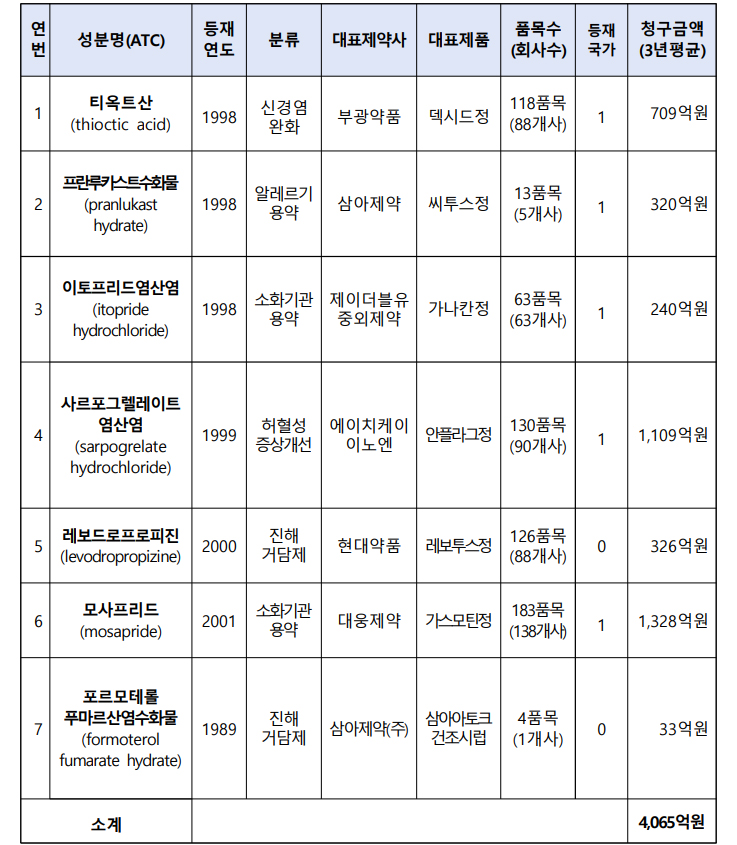
내년 급여적정성 재평가 대상 성분이 총 7개로 확정됐다. 국내 대형제약사 간판품목이 포함되면서 청구금액으로는 4천억원(3년 평균 청구금액 4065억원)이 넘는다.
31일 보건복지부에 따르면 건강보험정책심의위원회 논의 등을 거친 ‘2024년 급여적정성 재평가 대상 약제’는 이 같이 결정됐다.
지난 2020년부터 정부는 지난 약제비 지출 적정화를 위해 임상적 유용성이 미흡한 약제에 대한 급여적정성 재평가를 시행해 왔다.
지난 2020년 ‘콜린알포세레이트’ 1개 성분을 시작으로 2021년에는 건강기능식품과 혼용되는 4개 성분, 2022년에는 등재연도가 오래된(’89~91년) 6개 성분에 대해 평가를 완료했다.
2023년에는 등재 연도가 오래된(’93~97년) 히알루론산 점안제, 레바미피드, 룩소프로펜나트륨 등 8개 성분 약제에 대해 급여적정성 여부를 평가 중이다.
내년 대상 약제는 △부광약품 덱시드정이 대표 품목인 ‘티옥트산(709억원)’ △삼아제약 씨투스정 등 ‘프란루카스트수화물(320억원)’ △JW중외제약 가나칸정 등 ‘이토프리드염산염(240억원)’ △HK이노엔의 안플레이드 등 ‘사르포그렐레이트염산염(1109억원)’이다.
여기에 △현대약품 레보투스정이 있는 ‘레보드로프로피진(326억원)’ △대웅제약 가스모틴 등 ‘모사프리드(1328억원)’ △삼아제약 삼아아토크건조시럽 등 ‘프로모테롤푸미르산염수화물(33억원)’도 포함됐다.
이들은 선정 기준(연간 청구액 200억원 이상, 외국 1국 이하 급여)을 충족하는 성분 중, 정책적·사회적 요구에 따라 등재연도가 오래된 성분이다. 아울러 위원회가 재평가가 필요하다고 인정하는 경우다.
2006년 12월 선별등재 제도 시행 이전에 등재된 성분 중 임상적 유용성 등의 재평가가 필요하고, 식품의약품안전처 임상재평가 진행 성분 중 임상적 유용성이 불분명해 재평가 필요성이 제기된 성분이다.
실제 프로모테롤푸미르산염수화물을 제외한 6개 성분은 1998년부터 2001년 등재됐다. 프로모테롤푸미르산염수화물의 경우 식약처에서 임사재평가를 공고해 임상시험이 진행되고 있다.
재평가 규모가 가장 큰 성분은 소화기관용약 모사프리드다. 3년 평균 청구금액이 1323억원에 이르며 138개사 183품목이 허가됐다.
허혈성 증상 개선에 사용되는 사르포그렐레이트염산염도 청구 규모가 1109억원으로 집계됐다. 90개사 130품목이 건강보험 급여를 받고 있다.
복지부는 6월 재평가 대상 약제 등 재평가 추진 내용을 공고한 뒤 2024년 2월부터 제약사 근거자료 접수 등 재평가를 진행할 예정이다.
이와 함께 2023년도 재평가 평가 진행은 올해 12월까지 마무리하게 된다. 12월 말에는 재평가 결과를 건정심에서 심의한다는 계획이다.
12월 초까지 전문가 자문 및 제약사 이의신청 접수, 사후평가 소위원회, 약제급여평가위원회 심의 등을 모두 마쳐야 한다.
오창현 보험약제과장은 “약제 급여적정성 재평가 제도의 합리적이고 실효성 있는 운영을 위해 연구용역 결과 등을 바탕으로 세부적인 평가방법을 개선했다”고 밝혔다.
그는 “합리성을 위해 의학적 권고 평가시 문헌의 질적 수준을 종합적으로 고려토록 했다. 사회적 요구도에 있어서 평가 요소를 의료적·사회적·재정적 요소로 구체화했으며 평가위원회를 구성해 점수 방식으로 평가, 객관성을 갖췄다”고 강조했다.
내년 급여적정성 재평가 대상 7 . 4(3 4065) .
31 2024 .
2020 .
2020 1 2021 4 , 2022 (89~91) 6 .
2023 (93~97) , , 8 .
(709) (320) JW (240) HK (1109).
(326) (1328) (33) .
( 200 , 1 ) , . .
2006 12 , .
6 1998 2001 . .
. 3 1323 138 183 .
1109 . 90 130 .
6 2024 2 .
2023 12 . 12 .
12 , , .
.
. , .


