
미토콘드리아 유전질환 동물모델이 국내 연구진에 의해 개발됐다. 모계유전 질환의 새로운 치료법 등장이 기대된다.
고려대학교 의과대학 융합의학교실 이현지 교수팀은 최근 미토콘드리아 DNA 특정 서열에서 아데닌(A) 염기를 구아닌(G)로 변형한 생쥐를 제작하는 데 성공했다.
세포 내에 존재하는 에너지 공급원, 미토콘드리아는 그 내부에 에너지 대사에 필수역할을 하는 단백질 유전정보를 가진 미토콘드리아 DNA를 갖고 있다.
이 DNA 결함은 미토콘드리아 고장으로 이어지며 뇌, 신경, 근육에서 다양한 병증으로 나타난다.
또한 부모 중 모계유전으로만 전달되는 미토콘드리아 특성상 엄마의 미토콘드리아 결함이 자녀에게 유전돼 미토콘드리아 질환으로 발현될 수 있다.
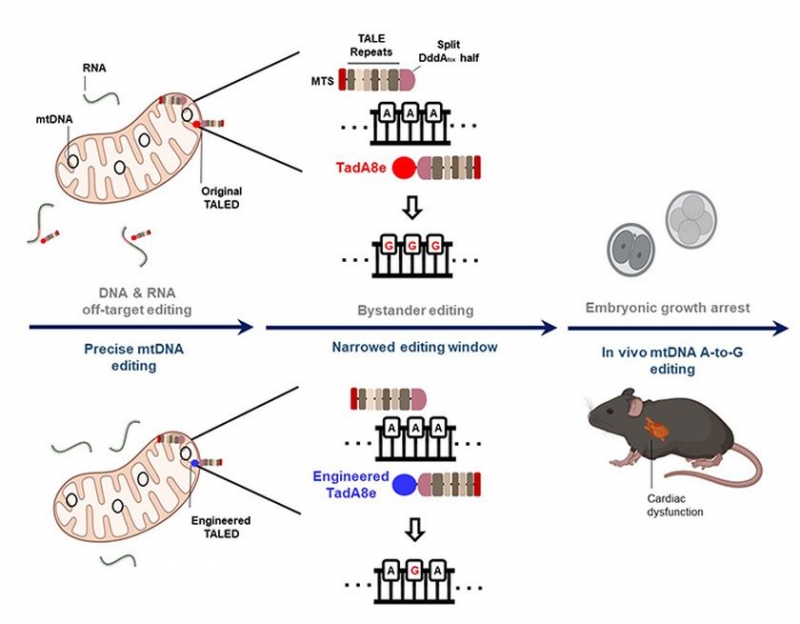
현재 크리스퍼 유전자 가위(CRISPR-Cas9) 기술이 DNA 교정기술로 활용되지만 미토콘드리아 DNA 교정에는 사용하지 못한다는 한계점이 존재한다.
연구진은 기존에 개발된 염기교정기술(TALED)이 세포 내에서 의도하지 않은 무작위적 DNA 및 RNA 변형을 일으킨다는 사실을 확인했다.
이로 인해 TALED가 생쥐의 수정란에 주입될 경우 배아 발달이 정상적으로 이뤄지지 못함을 발견했다.
이에 TALED 구성 단백질 중 DNA 변형을 매개하는 단백질이 더욱 정밀한 활성을 나타낼 수 있게 개량한 TALED(V28R-TALED)를 개발했다.
이를 통해 TALED의 부작용인 세포 내 무작위적 DNA 및 RNA 변형이 크게 감소된 것을 확인했다.
나아가 개량된 TALED를 생쥐의 수정란에 미세주입해 미토콘드리아 질환 ‘리 증후군(Leigh syndrome)’의 돌연변이를 보유, 병증을 나타내는 질환모델 제작에 성공했다.
연구진은 “미토콘드리아 유전병은 심각한 증상을 유발하는 경우가 많은데, 이를 극복하기 위한 새로운 기술을 개발하고, 그 기술을 발전시킨 좋은 예”라고 의미를 부여했다.
이어 “앞으로도 기술발전 및 부작용 연구를 매진하여 미토콘드리아 유전병 극복에 희망과 가능성을 제시하겠다”고 덧붙였다.
한편, 이번 연구는 최근 국제 학술지 셀(Cell, IF=66.85)에 게재됐다.

. .
DNA (A) (G) .
, DNA .
DNA , , .
.
(CRISPR-Cas9) DNA DNA .
(TALED) DNA RNA .
TALED .
TALED DNA TALED(V28R-TALED) .
TALED DNA RNA .
TALED (Leigh syndrome) , .
, , .
.
, (Cell, IF=66.85) .

