
 제약업계에 기허가 의약품 구조조정 바람이 불고 있다. 급여 적정성 평가에 이어 동등성(효능) 재평가까지 실시되면서 제약사들의 한숨도 깊어지고 있다.
제약업계에 기허가 의약품 구조조정 바람이 불고 있다. 급여 적정성 평가에 이어 동등성(효능) 재평가까지 실시되면서 제약사들의 한숨도 깊어지고 있다.
14일 식품의약품안전처가 향후 5년간 진행될 의약품 재평가 계획을 밝혔다. 기존에는 특정 성분·제형 품목에 대한 재평가가 이뤄졌지만, 이제부턴 전성분·제형 품목으로 대상이 확대된다.
이는 신규 품목 허가 시 생동성시험이 의무화되면서 기허가 의약품도 동등성 입증이 필요하다는 지적에 따른 것이다.
재평가는 두 가지로 나뉜다. 정기적인 생동 재평가는 2007년부터 대상 품목에 한해 실시됐고, 임상 재평가는 안전성, 유효성 또는 사회적 이슈 등으로 필요한 경우 특별하게 진행된다.
기허가 품목 재평가 현황을 보면, 2007년부터 2017년까지 정제·캡슐제·좌제 가운데 보험청구액이 많은 품목들이 심사 대상에 올랐다. 총 360개 성분 5907품목이 효능 입증을 마쳤다.
지난해에는 산제·과립제에 대한 재평가가 이뤄져, 실데나필 등 15개 81품목이 동등성 입증을 마쳤다.
올해는 점안제·점이제·폐흡입제·외용제제에 대한 재평가가 진행되고 있다. 오플록사신(점이제), 레보플록사신(점안제), 살부타몰(폐흡입제) 등 40개 성분 322품목이 도마 위에 올랐다.
내년부터 앞으로 3년간 정제·캡슐제·과립제 등 경구용 제제 약 6000개 품목, 2026년부터 주사제·외용제제 등 약 4000개 품목이 재평가 대상이다.
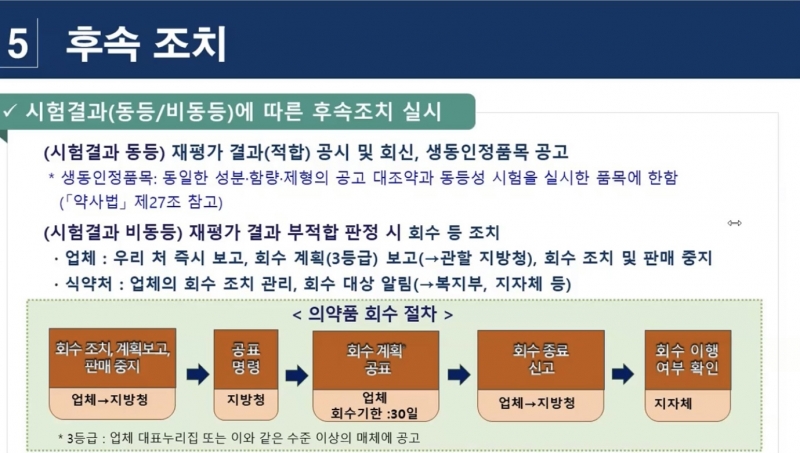
제약사들이 식약처 의약품 재평가를 두려워하는 이유는 동등성을 입증하지 못하면 제품 회수 등의 조치가 이어지기 때문이다. 쉽게 말해 시장에서 철수해야 된다는 의미다.
임상 재평가의 경우 임상 진행 기간 동안 지출된 건강보험료까지 환수가 될 수 있다. 이처럼 사활이 걸린 문제여서 제약업계는 촉각을 곤두세우고 있다.
동등성 재평가의 경우 자사가 보유한 제네릭 품목 중 어떤 품목을 진행해야 할지, 위탁 생산 품목은 어떻게 생동성 시험을 실시해야 하는지 등 고민이 깊다.
A제약사 관계자는 "정부가 앞으로 5년간 전체 성분 및 제형에 대한 재평가를 진행하는데, 우리 회사 제품 대다수가 포함될 것으로 보인다"며 "모두 생물학적동등성 시험을 하는 것은 부담이 커 선택과 집중을 해야 하지 않겠느냐는 논의를 하고 있다"고 말했다.
B제약사 관계자는 "동일 제조소에서 여러 회사가 위탁해 생산할 때 임상 또는 생동 재평가 자료로 제출할 수 있는 자료 허여 범위가 궁금하다"며 "현재 1+3 공동생동 제도가 시행되고 있어, 3개까지만 자료가 허용되면 여러차례 생동성시험을 해야 하기 때문"이라고 설명했다.
C제약사 관계자는 "심평원 급여 재평가와 식약처 효능 재평가가 동시에 몰아치니 정신이 없다"며 "코로나19 대유행으로 줄어든 매출을 회복하는 것도 힘들고, 대외 환경이 좋지 않아 걱정인데 재평가까지 한다고 하니 중소제약사 입장에선 걱정이 많다"고 토로했다.
식약처는 이 같은 업계 반응을 고려해서 재평가 계획을 사전에 공지했다는 입장이다. 대비할 시간을 충분히 주고, 필요에 따라 직접 상담도 진행할 방침이다.
식약처 의약품안전평가과 관계자는 "설명회를 통해 제약사들이 질의한 내용은 모두 답변해 공개할 예정이며, 대조약 선정 일정이나 생약제제에 대한 재평가 등은 내부 논의 후 공지하겠다"고 밝혔다.
