
(서울=연합뉴스) 한기천 기자 = 세계적으로 코로나19(신종 코로나바이러스 감염증) 백신 접종이 경쟁적으로 이뤄지면서 신종 코로나 바이러스의 항체 반응 회피가 새삼 주목받고 있다.
하지만 이 부분에 대해선 아직 규명되지 않은 게 많다. 사람에 따라 바이러스 감염에 맞서는 면역력과 항체 반응의 질이 천차만별이기 때문이다.
영국 프랜시스 크릭 연구소가 주도한 이 연구 결과는 이달 22일(현지 시각) 저널 '네이처(Nature)'에 논문으로 실렸다.
연구 중심 대학으로 명성이 높은 영국 임페리얼 칼리지 런던(ICL), 킹스 칼리지 런던, 유니버시티 칼리지 런던(UCL) 등의 과학자들도 연구에 참여했다.
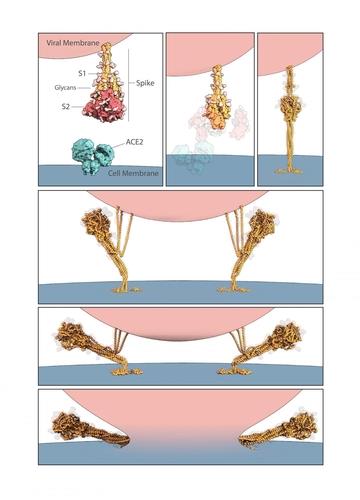
스파이크 단백질이 ACE2 수용체와 결합한 뒤 바이러스 입자의 외막과 숙주세포 막이 융합하는 과정을 보여주는 그래픽. [미 보스턴아동병원 연구진 저널 '사이언스' 논문 발췌/재판매 및 DB 금지]
녹색 쓸개즙의 색소 성분이기도 한 빌리베르딘은 적혈구에서 헤모글로빈의 헴(Heme)이 분해하면서 생성된다.
대식세포가 오래된 적혈구를 파괴할 때 헴은 헤모시데린과 빌리베르딘으로 분해되고, 빌리베르딘은 다시 유리 빌리루빈(bilirubin)으로 분해된다.
몸에 멍이 들었을 때 처음에 녹색으로 보이는 건 빌리베르딘의 색깔이 비치기 때문이다. 빌리베르딘이 빌리루빈으로 분해되면 멍 색깔은 황색으로 변한다.
이 빌리베르딘이 신종 코로나의 스파이크 돌기와 강하게 결합하면 항체의 스파이크 결합이 30% 내지 50% 억제됐고, 상당수의 항체가 바이러스 중화 능력을 상실했다.
극저온 전자현미경과 X선 결정학 기술로 관찰한 결과, 빌리베르딘은 스파이크 단백질의 N-말단 도메인(N-terminal domain)에 달라붙어 스파이크 단백질이 열린 구조로 변해 외부에 노출되는 걸 막았다.
이는 항체가 바이러스를 중화하기 위해 결합해야 하는 스파이크 단백질의 목표 지점 접근을 원천적으로 차단한다는 의미다. 놀랍게도 신종 코로나는 중화 항체를 피하는 데 이 메커니즘을 이용하는 것처럼 보였다.
일례로 신종 코로나가 폐에 감염하면 혈관이 손상되고 면역세포가 증가하는데 이 과정에서 주변 조직의 빌리베르딘(또는 빌리루빈) 수치가 올라간다는 것이다. 당연히 이들 분자가 많아지면 신종 코로나가 항체를 회피할 가능성도 커진다고 한다.
논문의 제1 저자인 아나치아라 로사 박사후연구원은 "바이러스가 스스로 유발한 손상의 부작용으로부터 (항체 회피의) 이득을 얻는다는 건 매우 인상적이다"라고 말했다.
연구팀은 스파이크 단백질의 빌리베르딘 결합 사이트를 가로채는 게 신종 코로나의 새로운 공략 표적이 될 수 있는지 확인하기로 했다.
아울러 코로나19 환자를 대상으로 빌리베르딘과 다른 헴 대사물 수치를 측정해 중증도와의 연관성 등을 분석할 계획이다.
한편, 적혈구는 폐의 신선한 산소를 다른 기관과 조직에 배달하는 주 기능 외에 면역 반응에도 관여하는 것으로 알려졌다. 표면에 달라붙은 병원체를 포박해 중화한 뒤 지라와 간의 '항원 제시 세포(APCs)에 전달하는 것이다.
미국 하버드대의 '비스 생물학적 영감 공학 연구소(Wyss Institute for Biologically Inspired Engineering)' 과학자들은 적혈구의 이런 기능에 착안해, EDIT(Erythrocyte-Driven Immune Targeting)라는 면역 반응 유도 플랫폼을 개발했다.
작년 7월 미국 국립과학원회보(PNAS) 논문으로 공개된 이 기술은 항원 단백질로 코팅된 나노 입자를 적혈구에 실어 지라(비장)의 APCs에 전달하는 것이다.
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
